Раздел 3. Кинетика реакции n-го порядка
Рассмотрим реакцию n–го порядка, протекающую по схеме:
n A→R (2.14)
Порядок реакции это сумма показателей степеней при концентрации реагирующих веществ в кинетическом уравнении реакции. Чаще всего порядок реакции не совпадает с ее молекулярностью так как суммарное стехиометрическое уравнении реакции, как правило, не может показать действительный механизм реакции, которая протекает через рад последовательных стадий. Реакции бывают первого, второго, третьего и дробного порядка.
Рассмотрим реакцию (2.14). Пусть начальные условия будут те же, что и для простой необратимой реакции:
T,V = const;
 СА = САо при τ = 0
СА = САо при τ = 0
СR = СRо =0
Если объем реакционной смеси постоянный V = const, то скорость реакции это изменение концентрации в единицу времени:
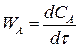 (2.15)
(2.15)
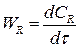 (2.16)
(2.16)
Составим кинетическую модель рассматриваемой реакции:
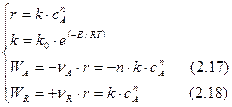
Сопоставим выражения (2.15) и (2.17 ), (2.16) и (2.18):
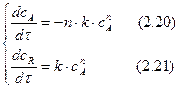
Определим изменение концентрации реагента А в ходе реакции. Для этого рассмотрим выражение (2.20). Разделим переменные, интегрируем его от САо до СА и от 0 до τ :
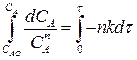
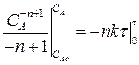
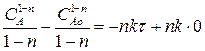
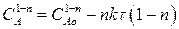 (2.22)
(2.22)
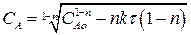 (2.23)
(2.23)
Выражение (2.23) представляет искомую зависимость СА = f(τ).
Найдем зависимость степени превращения от времени для рассматриваемой реакции. Вспомним, что СА=САо(1-хА). Подставим это выражение в (2.22):
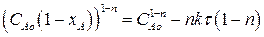
Разделим полученное выражение на САо1-n
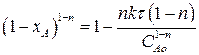
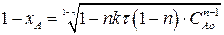
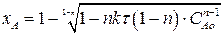 (2.24)
(2.24)
Выражение (2.24) представляет искомую зависимость хА = f(τ).
Дата добавления: 2020-10-14; просмотров: 614;











