ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ ПРИ РАСТВОРЕНИИ ВЕЩЕСТВ
Растворы. Классификация растворов.
Растворами называются гомогенные системы переменного состава, состоящие из двух или более компонентов.
Существуют растворы твердых, жидких и газообразных веществ в жидких растворителях, а также однородные смеси (растворы) твердых, жидких и газообразных веществ. В дальнейшем мы будем рассматривать только системы с жидким растворителем.
Раствор состоит из растворенных веществ и растворителя.
Растворитель – компонент, который преобладает и находится в том же агрегатном состоянии, что и раствор.
Истинные и коллоидные растворы
В растворах вещества могут находиться в различных степенях дисперсности (т.е. раздробленности). Величина частиц служит важным признаком, обуславливающим многие физикохимические свойства растворов.
По величине частиц растворы делятся на:
1. Истинные растворы (размер частиц меньше 1 мкм) и
2. Коллоидные растворы (размер частиц от 1 до 100 мкм).
Смеси с частицами размером более 100 мкм образуют взвеси: суспензии и эмульсии.
Истинные растворы могут быть ионными или молекулярными в зависимости от того, диссоциирует ли растворённое вещество на ионы или остаётся в недиссоциированном состоянии в виде молекул.
Коллоидные растворы резко отличаются по свойствам от истинных растворов. Они гетерогенны, так как имеют поверхность раздела между фазами – растворённым веществом (дисперсной фазой) и растворителем (дисперсионной средой).
В процессе растворения частицы (ионы или молекулы) растворяемого вещества под действием хаотически движущихся частиц растворителя переходят в раствор, образуя в результате беспорядочного движения частиц качественно новую однородную систему.
Процесс растворения является обратимым, так как может осуществляться не только переход частиц растворяемого вещества в раствор, но и выделение частиц из раствора в результате, например, процесса кристаллизации.
Через определенное время процессы растворения или выделения частиц при данных внешних условиях приводят систему к состоянию равновесия – состоянию, в котором скорости этих процессов равны. В состоянии равновесия образуются насыщенные растворы.
Насыщенным раствором называется такой раствор, который находится в равновесии с избытком растворяемого вещества – он содержит максимально возможное при данных условиях количество растворенного вещества.
Если скорость растворения превышает скорость выделения, то образуются ненасыщенные растворы, если наоборот – пересыщенные.
По соотношению количеств растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные (растворы, близкие к состоянию насыщения).
Концентрация насыщенного раствора для данного вещества при строго определенных условиях (Т, Р и растворитель) – величина постоянная и называется растворимостью вещества.
Растворимость – способность вещества растворятся в растворителе. Количественной характеристикой растворимости является коэффициент растворимости. Он показывает, какая максимальная масса вещества может растворится в 1000 мл (т.е. 1 литре) растворителя при данной температуре. Растворимость выражается в г/л.
По растворимости в воде вещества делятся на три группы:
1. Хорошо растворимые (в таблице растворимости обозначаются буквой «р») более 10г вещества в 1 л воды при температуре 20оС (сахар в воде);
2. Малорастворимые – «м» 0,01 – 10г на 1л воды ( сульфат кальция – гипс в воде);
3. Практически нерастворимые – «н» менее 0,01 г.
Растворимость зависит от природы растворителя, природы растворенного вещества, температуры и давления для газов.
Так растворимость газов при повышении температуры уменьшается, а при увеличении давления увеличивается. Растворимость же многих твердых веществ при нагревании увеличивается.
Зависимость растворимости от температуры показывают кривые растворимости. По ним можно определить: коэффициент растворимости веществ при различных температурах и массу растворенного вещества, которая выпадает в осадок при охлаждении раствора.
Количественной характеристикой растворимости является концентрация.
Концентрацией раствора называется количество растворенного вещества, содержащегося в определенном количестве раствора или растворителя.
Концентрацию раствора можно выражать по разному.
2. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
Массовая концентрация, массовая доля w– отношение массы растворенного вещества m[X] к массе всего раствора m[S]
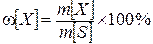
Массовая доля выражается в долях единицы или процентах.
Пример. 5%-ный раствор серной кислоты в 100 граммах раствора содержит 5 грамм H2SO4 и 95 грамм растворителя – воды.
Молярная концентрация, молярность СМ (М) – число молей растворенного вещества n[X], содержащегося в 1 л раствора V[S]
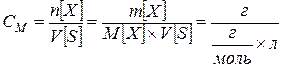 [моль/л; моль/см3]
[моль/л; моль/см3]
Различают обозначения:
0,1М – децимолярный;
0,01М – сантимолярный (0,02М – двусантимолярный);
0,001М – милимолярный.
Пример. 1,5М раствор H2SO4 или СМ = 1,5 моль/л H2SO4
В 1000 мл раствора содержится 1,5 моля серной кислоты или
в 1 л раствора содержится 1,5 ´ 98 = 147 г, где 98 – молярная масса серной кислоты.
Для пересчета молей в граммы используем молярную массу вещества.
Пример. Определите массу нитрата натрия, которая требуется для приготовления 2 л децимолярного раствора.
В 1 л раствора содержится СМ ´ М [X] = 0,1 ´ 85 = 8,5 г NaNO3
Составим пропорцию:
в 1 л раствора содержится 8,5 г NaNO3
в 2 л раствора содержится х г NaNO3
Тогда х = 17 г нужно взять, чтобы приготовить 2 л 0,1М раствора.
Эквивалентная концентрация, нормальность CН - число эквивалентов растворенного вещества nЕ, содержащихся в 1 л раствора V[S]
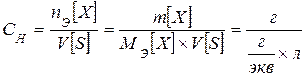 [экв/л; моль/л]
[экв/л; моль/л]
Различают обозначения:
0,1н – децинормальный;
0,01н – сантинормальный;
0,001н – милинормальный.
Если в растворе содержится 1 эквивалент вещества, то это 1н раствор.
Один эквивалент весит эквивалентную массу.
Пример. 0,75н раствор H2SO4 или CН = 0,75 моль/л H2SO4
В 1000 мл раствора содержится 0,75 моль серной кислоты или
в 1 л раствора содержится 0,75 ´ 49 = 36,75 г, где 49 – эквивалентная масса серной кислоты.
В общем виде:
в 1 л раствора содержится СН ´ МЭ[X]
в заданном V[S] раствора содержится х г
Моляльная концентрация, моляльность Cm – число молей растворенного вещества n[X], приходящихся на 1 кг растворителя mP
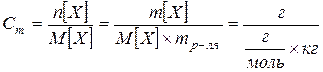 [моль/кг]
[моль/кг]
Пример. 2m раствор H2SO4
2 моля приходятся на 1000 г растворителя (т.е. воды)
Cm ´ М[X] приходятся на 1000 г растворителя
Титр Т – показывает количество граммов растворенного вещества m[X], содержащихся в 1 мл раствораV[S]
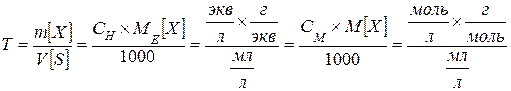 [г/мл]
[г/мл]
Пример. Титр раствора равен 0,0036 г/мл.
Это значит, что в 1 мл раствора содержится 0,0036г растворенного вещества.
Если растворы имеют разную нормальность, то применяют:
Закон эквивалентов для растворов
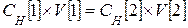
Объемы реагирующих веществ обратно пропорциональны их нормальностям.
ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ ПРИ РАСТВОРЕНИИ ВЕЩЕСТВ
Менделеев, посвятивший исследованиям растворов более сорока лет, первым указал, что в реальном растворе могут существовать не только частицы растворенного вещества и растворителя (Н2+Н2О, О2+Н2О, N2+Н2О), но часто может происходить химическое или физическое взаимодействие частиц растворяемого вещества с растворителем. Это легло в основу разработанной им гидратной теории растворов. Так, положительные и отрицательные ионы, имеющиеся в кристаллической решетке солей, могут за счет электростатического взаимодействия притягиваться к противоположно заряженным полюсам молекул растворителя.
Например, при растворении солей их катионы и анионы по закону электролитического взаимодействия могут притягивать или отталкивать полярные молекулы воды
[+(Н2О)–]…Na+…[–(Н2О)+]
[–(Н2О)+]…Cl–…[+(Н2О)–]
В результате таких столкновений ионы соли могут быть окружены одним или несколькими слоями молекул воды Молекул, которые получили название «гидратных оболочек».
Такие взаимодействия в ряде случаев приводят к глубоким химическим взаимодействиям и завершаются образованием соединений растворенного вещества с молекулами воды, эти соединения называются гидратами. Часто гидратная вода оказывается прочно связанной с веществом и при выделении его из раствора входит в состав его кристаллов.
Так безводный сульфат меди белого цвета, а кристаллогидрат сульфата меди – синий.
Растворение различных веществ сопровождается выделением или поглощением тепла. Это физико-химическое явление состоит из двух стадий:
1. разрушение кристаллической решетки
NaClкр  NaClраст
NaClраст
Этот процесс требует затрат энергии (эндотермический процесс). DH фаз.пер.
Эта стадия при растворении газов в жидком растворителе отсутствует, т.к. они не имеют кристаллической решетки.
2. равномерное распределение частиц вещества по всему объему раствора.
Молекулы растворенного вещества могут взаимодействовать с молекулами воды, что приводит к образованию гидратов. При этом в системе наблюдается возникновение новых связей, поэтому эта стадия является экзотермической. DH гидрат.
Суммарный тепловой эффект:
DH ратв. = DH фаз.пер. + DH гидрат.
Дата добавления: 2020-10-14; просмотров: 553;











