Регуляция активности аллостерических ферментов
Аллостерическая регуляция основана на изменениях конформации фермента, ведущей к изменению его активности. Аллостерическая регуляция является одним из самых быстродействующих и гибких типов модуляции активности ключевых метаболических ферментов. Она осуществляется с помощью молекул-эффекторов, взаимодействующих с аллостерическим центром фермента. Обычно аллостерический фермент построен из субъединиц, которые могут существовать в активной и неактивной конформации, и аллостерический эффектор промотирует превращение одной конформации в другую.
Аллостерическими эффекторами могут выступать самые различные вещества: субстраты и конечные продукты метаболических путей, иногда – промежуточные метаболиты; в катаболических процессах ‒ нуклеозиддифосфаты и нуклеозидтрифосфаты, а также переносчики восстановительных эквивалентов; в каскадных реакциях сАМР и сGMP, которые регулируют активность ферментов (например, протеинкиназ), участвующих в ковалентной модификации белков; ионы металлов и множество иных соединений.
Рассмотрим регуляцию аллостерических ферментов на примере фосфофруктокиназы и аспартаткартамоил-трансферазы (АКТФ).
Фосфофруктокиназа (ФФК) – один из наиболее хорошо изученных аллостерических ферментов. Это тетрамер, каждая субъединица которого содержит активный центр. Аллостерические центры располагаются на поверхности контакта двух субъединиц (рис. 4.2.1).
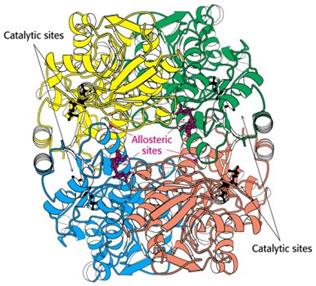
Рис. 4.2.1. Строение фосфофруктокиназы
Фосфофруктокиназа – поливалентный аллостерический фермент, активность которого регулируется разными внутриклеточными соединениями. Ингибиторами ФФК являются АТР, цитрат и концентрация протонов водорода. АТР является одновременно субстратом и аллостерическим ингибитором этого фермента.
Высокие уровни АТР изменяют кинетическое поведение ФФК, превращая гиперболическую зависимость (область низких концентраций АТР) в сигмоидную (рис. 4.2.2).
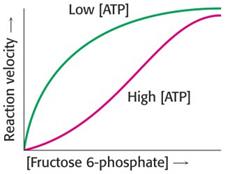
Рис. 4.2.2. Зависимость скорости фосфофруктокиназной реакции от концентрации фруктозо-6-фосфата в области низких и высоких концентраций АТР
Аллостерическими активаторами ФФК являются АМР и фруктозо-2,6-дифосфат, которые могут снимать ингибирующий эффект АТР. На рис. 4.2.3 показано влияние фруктозо-2.6-дифосфата на зависимость скорости реакции, катализируемой фосфофруктокиназой, от концентрации субстратов – фруктозо-6-фосфата и АТР.
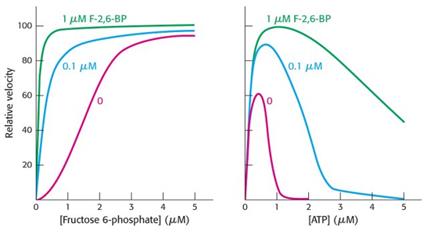
Рис. 4.2.3. Влияние различных концентраций фруктозо-2,6-дифосфата на зависимость скорости фосфофруктокиназной реакции от концентрации фуктозо-6-фосфата и АТР
Аспартаткарбамоилтрансфераза (АКТФ) – фермент, катализирующий скорость-лимитирующую реакцию в анаболическом пути синтеза пиримидиновых нуклеотидов. Она катализирует перенос карбамоильного остатка с карбамоилфосфата на аминогруппу L-аспартата. Образующийся N-карбамоил-L-аспартат содержит уже все атомы будущего пиримидинового кольца. Бактериальная АКТФ E. coli состоит из 12 субъединиц, шесть из которых являются каталитическими, другие шесть – регуляторными. На рис. 4.2.4 приведена субъединичная структура АКТФ (каталитические субъединицы окрашены в голубой и зеленый цвет, регуляторные – оттенки желтого).
Последние связывают аллостерические эффекторы CTP и АТР. Как и гемоглобин АКТФ может существовать в двух конформациях: менее активном Т-состоянии (от англ. tense — напряженное) и более активном R-состоянии (от англ. relaxed — расслабленное). Субстрат и эффекторы влияют на равновесие между обоими состояниями и тем самым на сигмоидность кривой. С возрастанием концентрации аспартата равновесие смещается к R-форме. АТР стабилизирует R-состояние путем связывания с регуляторной субъединицей. Напротив, присоединение СТР содействует переходу в Т-состояние. Структурные перестройки между R- и Т-состояниями особенно драматичны в случае АКТФ, поскольку при Т→R-переходе каталитические субъединицы удаляются друг от друга на 1,2 нм; кроме того, субъединицы поворачиваются вокруг оси симметрии. При этом сами конформации субъединиц меняются незначительно.
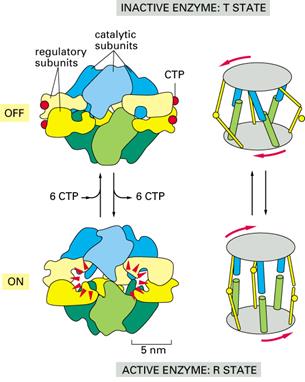
Рис. 4.2.4. Структура аспартаткарбамоилтрансферазы
Аллостерические эффекторы в зависимости от природы фермента могут влияять на максимальную скорость реакции – Vmax, на [S]0,5 и коэффициент Хилла – h. Если изменяется преимущественно Vmax, то фермент относится к так называемому V-типу ферментов. Ферменты, у которых у которых аллостерические эффекты отражаются только на [S] 0,5 и h, относятся к так называемому, К-типу аллостерических ферментов. АКТФ, наряду с гемоглобином, относится к К-типу аллостерических ферментов.
АКТФ имеют сигмоидную (S-образную) кривую насыщения субстратом – аспартатом. Активность фермента ингибируется цитидинтрифосфатом CTP — конечным продуктом анаболического пути обмена пиримидинов и активируется начальным участником — АТР. Ингибитор СТР вызывает смещение кривой зависимости скорости реакции от концентрации аспартата вправо с возрастанием [S]0,5 и h (рис. 4.2.5, кривая II). Активатор АТР, напротив, вызывает смещение влево; он уменьшает как [S] 0,5, так и h (рис. 4.2.5, кривая III).
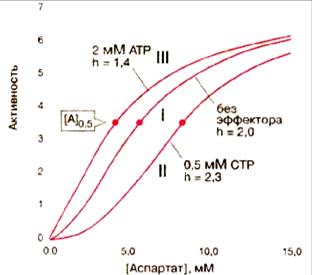
Рис. 4.2.5. Зависимость скорости реакции, катализируемой аспартаткарбамоилтрансферазой (I – нативный фермент; II – фермент в присутствии СТР; III – фермент в присутствии АТР)
При регуляции мультиферментных комплексов таких, как, например, пируватдегидрогеназный комплекс, аллостерические механизмы осуществляются как участниками процесса окислительного декарбоксилирования пирувата (рис. 4.2.6 А), так и внешними по отношению к данному процессу, метаболитами (рис. 4.2.6 Б).
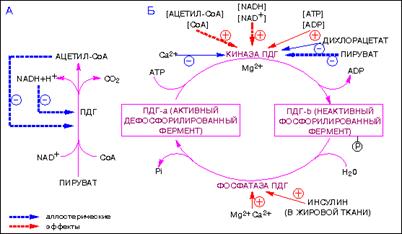
Рис. 4.2.6. Регуляция активности пируватдегидрогеназы (А – аллостерическая регуляция пируватдегидрогеназы; Б – аллостерическая регуляция киназы пируватдегидрогеназы; ковалентная модификация пируватдегидрогеназы ( + –положительный эффект, - отрицательный)
Дата добавления: 2020-10-01; просмотров: 678;











