Вандерваальсовы силы
Взаимодействие между молекулами. Комплексные соединения
В предыдущей главе было рассмотрено взаимодействие атомов с образованием молекул, а также представлены структуры и некоторые свойства молекул. Настоящая глава посвящена взаимодействию молекул.
При сближении молекул появляется притяжение, что обусловливает возникновение конденсированного состояния вещества. К основным видам взаимодействия молекул следует отнести вандерваальсовы силы, водородные связи и донорно-акцепторное взаимодействие.
Вандерваальсовы силы
В 1873 г. голландский ученый И. Ван-дер-Ваальс предположил, что существуют силы, обусловливающие притяжение между молекулами. Эти силы позднее получили название вандерваальсовых сил. Они включают в себя три составляющие: диполь-дипольное, индукционное и дисперсионное взаимодействия.
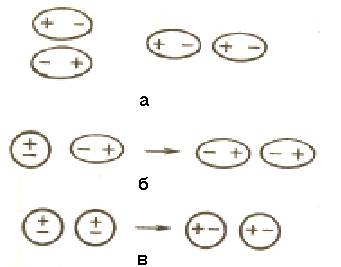
а – диполь-дипольное взаимодействие; б - индукционное взаимодействие;
в – дисперсионное взаимодействие
Рисунок 6.1 – Вандерваальсовы взаимодействия молекул
6.1.1 Диполь-дипольное взаимодействие.При сближении полярных молекул они ориентируются таким образом, чтобы положительная сторона одного диполя была ориентирована к отрицательной стороне другого диполя (рисунок 6.1, а).
Возникающее между диполями взаимодействие называется диполь-дипольным или ориентационным. Энергия диполь-дипольного взаимодействия пропорциональна электрическому моменту диполя в четвертой степени и обратно пропорциональна расстоянию между центрами диполей в шестой степени и абсолютной температуре в первой степени.
6.1.2 Индукционное взаимодействие.Диполи могут воздействовать на неполярные молекулы, превращая их в индуцированные (наведенные) диполи (рисунок 6.1, б). Между постоянными и наведенными диполями возникает притяжение, энергия которого пропорциональна электрическому моменту диполя во второй степени и обратно пропорциональна расстоянию между центрами молекул в шестой степени. Энергия индукционного взаимодействия возрастает с увеличением поляризуемости молекул, т.е. способности молекулы к образованию диполя под воздействием электрического поля. Величину поляризуемости выражают в единицах объема. Поляризуемость в однотипных молекулах растет с увеличением размера молекул (таблища 6.1). Энергия индукционного взаимодействия значительно меньше энергии диполь-дипольного взаимодействия.
6.1.3 Дисперсионное притяжение.В любой молекуле возникают флуктуации электрической плотности, в результате чего появляются мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи у соседних молекул (рисунок 6.1, в). Движение мгновенных диполей становится согласованным, их появление и распад происходит синхронно. В результате взаимодействия мгновенных диполей энергия системы понижается. Энергия дисперсионного взаимодействия пропорциональна поляризуемости молекул и обратно пропорциональна расстоянию между центрами частиц. Для неполярных молекул дисперсное взаимодействие является единственной составляющей вандерваальсовых сил (таблица 6.1).
Таблица 6.1 - Вклад отдельных составляющих в энергию молекулярного взаимодействия
| Вещество | Электри- ческий момент диполя, D | Поляризу- Емость, м3*1030 | Энергия взаимодействия, кДж/моль | Темпера- тура кипения, К | |||
| Ориентации- онная | Индукции- онная | Десперси- онная | суммарная | ||||
| H2 Ar Xe HCl HBr Hl NH3 | 1,03 0,78 0,38 1,52 | 0,8 1,64 4,16 2,64 3,62 5,42 2,23 | 3,3 1,1 0,6 13,3 | 1,0 0,70 0,3 1,5 | 0,17 8,5 18,4 16,8 28,5 60,6 14,7 | 0,17 8,5 18,4 21,1 30,3 61,5 29,5 | 20,2 239,6 |
6.1.4 Энергия вандерваальсова взаимодействия.Энергия всех видов вандерваальсова взаимодействия обратно пропорциональна расстоянию между центрами молекул в шестой степени.
При сильном сближении молекул проявляются силы отталкивания между ними, которые обратно пропорциональны расстоянию между молекулами в двенадцатой степени. Поэтому зависимость результирующей энергии вандерваальсова взаимодействия EB от расстояния между молекулами, IB, выражается уравнением
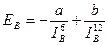 , (6.1)
, (6.1)
где а и b — постоянные.
Минимальная энергия системы обеспечивается при расстояниях между центрами молекул 0,4÷0,5 нм, т.е. существенно больше длины химической связи.
Как видно из таблицы 6.1, с увеличением размера молекул в ряду Аг—Хе и НС1—HI растет их поляризуемость и энергия дисперсионного притяжения. Ориентационное взаимодействие вносит значительный вклад в вандерваальсовы силы лишь в случае молекул с большим электрическим моментом диполя. С увеличением суммарной энергии межмолекулярного взаимодействия возрастет температура кипения жидкостей, а также теплота их испарения. Суммарная энергия вандерваальсового взаимодействия молекул на 1—2 порядка ниже энергии химических связей.
Итак, между молекулами возникают относительно слабые вандерваальсовы взаимодействия, включающие дисперсионные силы, а для полярных молекул и диполь-дипольное притяжение и индукционные взаимодействия.
Водородная связь
6.2.1 Общие понятия.Химическая связь, образованная положительно поляризованным водородом молекулы А—Н (или полярной группы—А-Н) и электроотрицательным атомом В другой или той же молекулы, называется водородной связью
Если водородная связь образуется между разными молекулами, она называется межмолекулярной, если связь образуется между двумя группами одной и той же молекулы, то она называется внутримолекулярной. Водородная связь между молекулами А-Н и B-R обозначается тремя точками
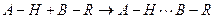 .
.
водород в данном случае образует две химические связи, причем они не равноценны.
Образование водородной связи обусловлено тем, что в полярных молекулах А-Н или полярных группах -А-Н поляризованный атом водорода обладает уникальными свойствами: отсутствием внутренних электронных оболочек, значительным сдвигом электронной пары к атому с высокой электроотрицательностью и очень малым размером. Поэтому водород способен глубоко внедряться в электронную оболочку соседнего отрицательно поляризованного атома.
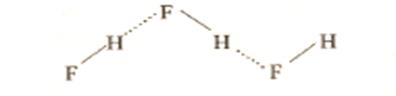
Атомы А и В могут быть одинаковыми, как при взаимодействии HF
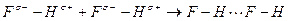 .
.
но могут быть и разными, как при взаимодействии воды и фтороводорода
6.2.2 Энергия и длина водородной связиЭнергия водородной связи возрастает с увеличением электроотрицательности (ЭО) и уменьшением размеров атомов В. Поэтому наиболее прочные водородные связи возникают, когда в качестве атомов В выступают F, О или N. Энергия связи (кДж/моль) возрастает в ряду
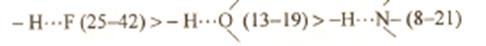
|
Несмотря на высокую ЭО у хлора, водородная связь 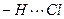 - относительно слабая из-за большого размера атома хлора.
- относительно слабая из-за большого размера атома хлора.
|
Как видно, энергия водородной связи имеет промежуточное значение между энергией ковалентной связи и вандерваальсовых сил. Также промежуточные значения имеют длины водородных связей. Так, в полимере (НF)n
длина связи F-H = 0,092 нм, а связи 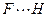 — 0,14 нм. У воды длина связи О-Н — 0,096 нм, а связи
— 0,14 нм. У воды длина связи О-Н — 0,096 нм, а связи 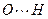 — 0,177 нм.
— 0,177 нм.
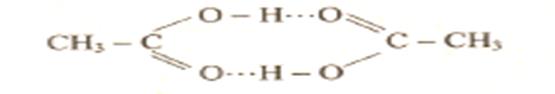
|
6.2.3 Влияние водородных связей на свойства веществПри возникновении водородных связей образуются димеры, тримеры или полимерные структуры, например зигзагообразные структуры (НF)n, кольцевые структуры некоторых органических кислот, например уксусной кислоты
или более сложные конфигурации, например у льда, у которого молекулы воды образуют по четыре водородные связи
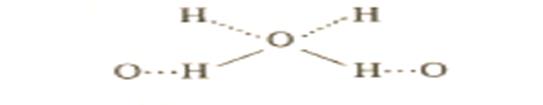
|
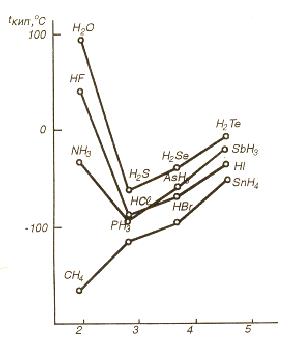
Рисунок 6.2 – Температуры кипения некоторых соединений водорода
Соответственно в жидком состоянии молекулы, вступающие в водородные связи, ассоциированы, а в твердом состоянии образуют сложные кристаллические структуры.
Образование межмолекулярных водородных связей приводит к существенному изменению свойств веществ: повышению вязкости, диэлектрической постоянной, температур кипения и плавления, теплот плавления и парообразования. Например, вода, фтороводород и аммиак имеют аномально высокие температуры кипения (рисунок 6.2) и плавления. Под влиянием водородных связей изменяются химические свойства. Например, HF — слабая кислота, в то время ее аналог НСl — сильная кислота.
6.2.4 Внутримолекулярные водородные связи Водородная связь может также возникнуть между атомами водорода и отрицательными атомами полярных групп в одной и той же молекуле. Например, в о-нитрофеноле (а) и салициловом альдегиде (б)
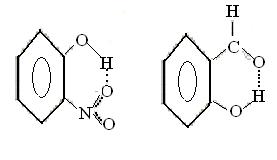
а б
возникает водородная связь между водородом групп –О-Н и кислородом других групп.
Молекулы с внутримолекулярными водородными связями не могут вступать в межмолекулярные водородные связи. Поэтому вещества с такими связями не образуют ассоциатов, более летучи, имеют более низкие вязкости, температуры кипения и плавления, чем их изомеры, способные образовать межмолекулярную связь.
6.2.5 Значение водородных связей Так как многие соединения содержат ковалентные полярные связи Н-О и H-N, то водородные связи очень распространены. Они проявляются не только в воде, но и в различных кристаллических веществах, полимерах, белках, живых организмах. Например, практически все соли образуют кристаллогидраты, в которых имеются водородные связи. Вследствие невысоких значений энергии водородные связи относительно легко разрушаются и вновь возникают.
Важную роль водородные связи играют в белках, у которых спиральные полимерные структуры объединяются связями N-H---O.
Итак, между полярными молекулами, содержащими в одной или обоих молекулах атом водорода, возникают водородные связи, которые существенно влияют на свойства вещества.
Дата добавления: 2021-11-16; просмотров: 860;











