Пространственной структуры белка
Как показали результаты рентгеноструктурного анализа белковых кристаллов, пространственная (третичная) структура каждого белка характеризуется сочетанием элементов вторичной структуры (α-спиралей, β-тяжей), а также гибких участков полипептидной цепи, называемых петлями. Способность того или иного участка полипептидной цепи образовывать элемент вторичной структуры (например, свернуться в α-спираль) зависит от характера аминокислотной последовательности данного отрезка цепи. Таким образом, число и расположение α-спиралей, β-тяжей и петель по ходу полипептидной цепи различно у разных белков и определяется генетическим кодом. Этим объясняется потенциальная способность любой полипептидной цепи к спонтанному сворачиванию в уникальную третичную структуру.
Согласно современным представлениям, процесс сворачивания имеет иерархическую природу (рис. 1.3.1): вначале очень быстро (за миллисекунды) формируются элементы вторичной структуры, служащие как бы «затравками» для образования более сложных архитектурных мотивов (стадия 1).
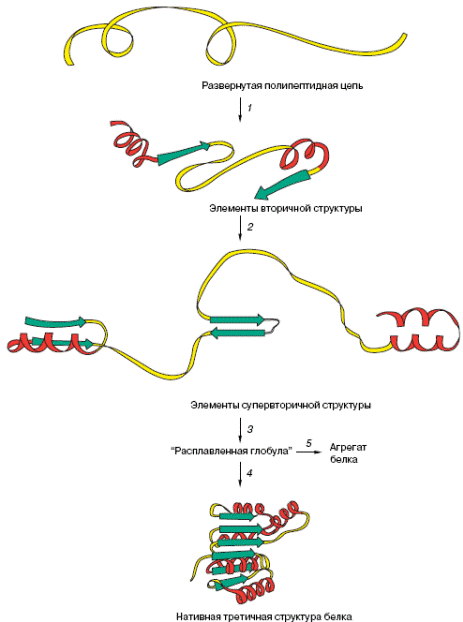
Рис. 1.3.1. Стадии сворачивания полипептидной цепи в нативную конформацию (1-4). 4 – Переход от состояния «расплавленной глобулы» к нативной пространвтвенной структуре белка, 5 – неспецифическая агрегация белка. Стрелки изображают β-тяжи
Второй стадией (также происходящей очень быстро) является специфическая ассоциация некоторых элементов вторичной структуры с образованием супервторичной структуры (это могут быть сочетания нескольких α-спиралей, нескольких β-цепей либо смешанные ассоциаты данных элементов) (стадия 2). Следующим этапом, играющим важнейшую роль для формирования уникальной «архитектуры» белка, является образование специфических контактов между участками, значительно удаленными один от другого в аминокислотной последовательности, но оказывающимися сближенными в третичной структуре. Полагают, что это главным образом гидрофобные взаимодействия, обусловленные сближением неполярных групп и вытеснением молекул воды, расположенных между ними. Для формирования уникальной пространственной структуры каждого белка необходимо, чтобы образовалось определенное (оптимальное в каждом случае) число таких специфических контактов. На пути к достижению оптимального варианта возможны ошибки, образование «неправильных» контактов; в этом случае происходит перебор разных вариантов структуры до тех пор, пока не будет достигнут тот единственный вариант, который соответствует функционально активному состоянию данного белка.
На пути, ведущем от образования элементов супервторичной структуры к окончательному сворачиванию цепи в компактную глобулу, имеется промежуточная стадия (стадия 3), связанная с формированием основных элементов третичной структуры (специфического сочетания α-спиралей, β-тяжей, соединяющих петель) и образованием гидрофобного ядра молекулы. Молекула приобретает пространственную структуру, близкую к структуре нативного белка. Вместе с тем, она еще не обладает присущей данному белку функциональной активностью. Это состояние, получившее название «расплавленная глобула», отличается от нативного меньшей степенью упорядоченности структуры (рис. 1.3.2). Элементы вторичной структуры представлены на рисунке двумя спиральными участками (цилндры). Заштрихованные фигуры изображают неполярные группы аминокислотных остатков. Эти неполярные группы, формирующие гидрофобное ядро молекулы, «упакованы» недостаточно плотно.
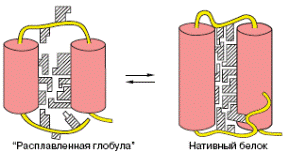
Рис. 1.3.2. Схематическое изображение структуры «расплавленной глобулы» по сравнению со структурой нативного белка
Отсутствие ряда специфических взаимодействий приводит к изменению ориентации подвижных петель; в целом молекула более лабильна и склонна к «слипанию» с другими такими же молекулами с образованием агрегатов. Таким образом, неспецифическая агрегация (стадия 5 на рис. 1) может уменьшать число молекул белка, находящихся на правильном пути сворачивания (стадия 4 на рис. 1), то есть снижать эффективность этого процесса. Как показали модельные эксперименты, проведенные in vitro, образование «расплавленной глобулы» происходит значительно быстрее, чем ее переход в нативную структуру; реакция 4 (связанная с перебором разных конформаций) является, таким образом, самой медленной стадией процесса сворачивания.
Вероятность агрегации сильно возрастает при повышении температуры и концентрации белка, поэтому эффективное спонтанное сворачивание полипептидной цепи происходит в разбавленных растворах и при низких температурах. Обращаясь к ситуации, имеющей место in vivo, мы должны признать, что условия, существующие в клетке, сильно отличаются по этим параметрам. И вместе с тем, в физиологических условиях вновь синтезируемые полипептидные цепи сворачиваются достаточно быстро и эффективно. Следовательно, в клетке должны существовать специальные механизмы регуляции процесса сворачивания.
Дата добавления: 2020-10-01; просмотров: 836;











