Денатурация белков под давлением
Экспериментальные исследования
Впервые про денатурацию белков под давлением сообщил Бриджман в 1914 году [83]. Однако, всплеск интереса к обратимой денатурации белков (ribonuclease A [84,85], chymotrypsinogen [86] и metgemoglobin [87]) под давлением произошел гораздо позже, в конце 1960-х – начале 1970-х. Этот список дополняют недавние исследования lysozyme [88] и staphylococcal nuclease [89]. Установлено [90], что при частичной денатурации миозина, обусловленной повышением давления (как и при тепловой денатурации), происходит агрегация его молекул. Характерные уменьшения объема при денатурации этих белков лежат в интервале от 15 до 100 мл/моль при нормальных условиях. Эти изменения малы в сравнении с их парциальными молярными объемами, которые превышают 10000 мл/моль. Величины экспериментальных значений 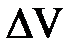 показывают, что парциальные молярные объемы нативного и денатурированного белка мало отличаются – развернутая форма меньше на ~0,5%, что кажется довольно странным [14]. Например, уменьшение объема при денатурации Rnase A при атмосферном давлении, рН = 2,0 и 21 0С составляет всего около 6 мл/моль, т.е. 0,07% парциального объема исходного белка Rnase A при этих условиях (8800 мл/моль) [91]. К тому же, эти изменения мало зависят от молекулярной массы – большие и меньшие белки имеют приблизительно одинаковое изменение объема при денатурации [41]. Исследователи указывают на отсутствие согласованного объяснения физических причин малого отрицательного изменения объема при денатурации – так называемый «парадокс белкового объема» [92].
показывают, что парциальные молярные объемы нативного и денатурированного белка мало отличаются – развернутая форма меньше на ~0,5%, что кажется довольно странным [14]. Например, уменьшение объема при денатурации Rnase A при атмосферном давлении, рН = 2,0 и 21 0С составляет всего около 6 мл/моль, т.е. 0,07% парциального объема исходного белка Rnase A при этих условиях (8800 мл/моль) [91]. К тому же, эти изменения мало зависят от молекулярной массы – большие и меньшие белки имеют приблизительно одинаковое изменение объема при денатурации [41]. Исследователи указывают на отсутствие согласованного объяснения физических причин малого отрицательного изменения объема при денатурации – так называемый «парадокс белкового объема» [92].
В отличие от белков, денатурация молекул ДНК вызывает небольшое увеличение объема [93, 94, 95], поэтому давление стабилизирует ДНК в нативном состоянии. Давление противодействует денатурирующему эффекту высокой температуры и повышает температуру «плавления» ДНК на несколько градусов.
Активационно-инактивационная модель поведения белков
При изменении давления или температуры денатурация белков может иметь как обратимый, так и необратимый характер. Давление ускоряет реакции, идущие с уменьшением объема, однако, изменение объема белков при увеличении давления происходит в различных направлениях [96], что связано с большим разнообразием взаимодействий, определяющих структуру белка [97].
В работе [87] изучена денатурация метмиоглобина путем сравнения дифференциального поглощения света геминовой группой молекулы этого белка в нативном и денатурированном состоянии. Показано, что давление до 350 МПа практически не влияет на метмиоглобин. Далее, на сравнительно узком участке давлений от 350 до 500 МПа, белок претерпевает кооперативную обратимую денатурацию. Было выявлено, что изменения объема при денатурации белков достаточно незначительны, что противоречит представлению о силах, которые поддерживают конформационную устойчивость белков. Принято считать, что основную роль в определении нативной конформации белков играют гидрофобные взаимодействия [97, 98]. Нарушение таких взаимодействий обычно приводит к уменьшению объема приблизительно на 10–20 мл/моль [99].
На основании изучения денатурации белка хемотрипсина под действием давления в работе [100] построены графики изменения свободной энергии при денатурации в зависимости от температуры и давления. Изменение свободной энергии составляет – 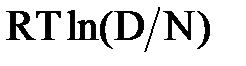 , где (D) и (N) – количество белка в денатурированном и нативном состоянии соответственно. Кривые Хоули, которые выполняются при условии (D)=(N), представляют собой замкнутые эллипсы. При изучении денатурации метмиоглобина авторы [87] расширили этот анализ путем введения оси рН и получили пространственную замкнутую структуру. При постоянной температуре (например, T=200C) условие (D)=(N) выполняется при рН=6 и Р= 430 МПа, рН = 5 и Р = 300 МПа, рН = 4 и Р = 90 МПа. В работе [101] исследована взаимосвязь уровней давления и рН при ингибировании роста бактерий. Сопоставляя данные, полученные в ходе этих исследований, с результатами опытов по денатурации белков, можно заметить следующую закономерность – с возрастанием давления область рН, при которой возможно возрастание, сужается.
, где (D) и (N) – количество белка в денатурированном и нативном состоянии соответственно. Кривые Хоули, которые выполняются при условии (D)=(N), представляют собой замкнутые эллипсы. При изучении денатурации метмиоглобина авторы [87] расширили этот анализ путем введения оси рН и получили пространственную замкнутую структуру. При постоянной температуре (например, T=200C) условие (D)=(N) выполняется при рН=6 и Р= 430 МПа, рН = 5 и Р = 300 МПа, рН = 4 и Р = 90 МПа. В работе [101] исследована взаимосвязь уровней давления и рН при ингибировании роста бактерий. Сопоставляя данные, полученные в ходе этих исследований, с результатами опытов по денатурации белков, можно заметить следующую закономерность – с возрастанием давления область рН, при которой возможно возрастание, сужается.
Легко заметить схожесть между реакцией микроорганизмов на комбинированное действие давления, температуры и рН и влиянием этих факторов на денатурацию белков. Не исключено, что в большинстве случаев неспособность микроорганизма расти, при повышенном давлении объясняется обратимой денатурацией ферментов или других клеточных белков. Общие проблемы действия давления на ферменты рассмотрены в [102]. При инактивации ферментов давлением происходит изменение структуры внутренне-молекулярных образований и конфигурации активных участков [103]. На инактивацию ферментов под давление влияет также рН, концентрация субстрата и особенности внутренней структуры активных участков [102]. Предполагается, что в некоторых микроорганизмах ферменты отыгрывают ключевую роль в процессах инактивации под действием давления.
Зависимость степени необратимости денатурации от структуры белков
Микробиальная инактивация при воздействии давления связана с разной способностью тех или иных составных частей белков восстанавливать свою способность к росту, слиянию и метаболизму. Высокое давление не разрывает ковалентные связи, однако изменяет систему водородных и ионных связей, ответственных за сохранение биологической активности белков. Таким образом, наблюдаемая кинетика инактивации микробов может быть обусловлена необратимой денатурацией наиболее важных протеиновых структур в микроорганизме. Зависимость степени необратимости денатурации белков от их структуры, возможно, обуславливает наблюдаемый разброс устойчивости разнообразных вегетативных форм микробов (даже внутри одного вида) до обработки высоким давлением. Так в выборке из 100 штаммов Listeria monocytogenes, обработанных давлением, наблюдался 6-кратный разброс в величинах D-значений [53].
Механизм действия высокого давления на белки
Одной из характерных особенностей влияния давления на структурную организацию белковых молекул является увеличение степени их денатурации при таком тепловом воздействии, которое само по себе не вызывает никаких изменений в структуре белка [104, 105]. Экспериментально установлено, что, в отличие от тепловой денатурации, коагуляция белков под давлением частично обратима. На основании данных ИК-спектроскопии с Фурье-преобразованием был сделан вывод о разной степени денатурации белков в этих двух методах обработки [106]. Безусловно, то, что из данных одного, даже самого современного, исследования нельзя сделать однозначного вывода об особенностях денатурации белков в тех или иных процессах. Причинами денатурации белка могут быть изменения или рН, или ионной силы раствора, или донорно-акцепторных взаимодействий [107], и конечно же температура. В этих условиях могут возникать эффекты переориентации связей, ослабляться Ван-дер-Ваальсовы взаимодействия, что может приводить к глубоким изменениям белков на разных уровнях их организации.
Данные некоторых исследований [108] свидетельствуют о разрушении четвертичной и третичной структуры белков под действием давления. В частности, активность полифенолоксидазы, экстрагированной из грибов, постепенно снижалась при увеличении давления в диапазоне 100-800 МПа и длительности обработки (1-20 минут). Полная инактивация фермента достигалась при обработке давлением 800 МПа на протяжении 5 минут. Подобная потеря активности происходила при относительно мягкой термической обработке (600С) на протяжении 30 минут при атмосферном давлении и была необратимой. Более подробные исследования при помощи жидкостной хроматографии показали, что на первой стадии инактивации фермента происходит «развертывание» его структуры с дальнейшей агрегацией. Процесс этот неоднозначен даже для одной и той же группы ферментов, полученных из разного сырья. Например, полифенолоксидазы из грибов и картофеля по-разному реагировали на обработку давлением. Обработка высоким давлением альбуминов бычьей сыворотки [109] снижала их гидрофобность, было показано, что под влиянием давления 400 МПа происходит их интенсивное развертывание и дальнейшая агрегация.
Дата добавления: 2021-09-25; просмотров: 987;











