Химия твердого состояния
Область науки о твердых растворах металлов до недавнего времени именовалась обычно химией металлических сплавов. В связи с расширением исследований в этой области и включением в предмет изучения продуктов взаимодействия металлов с металлоидами (кислородом, углеродом, кремнием, азотом, фосфором, серой и т.д.) появилась новая; более широкая область химической науки - металлохимия. Однако многие фундаментальные вопросы, рассматриваемые металлохимией, являются общими для кристаллохимии в целом. Более того, некоторые из таких общих вопросов в какой-то мере начинают выходить за рамки кристаллохимии; к ним относятся, например, вопросы о взаимосвязи между явлениями хемосорбции, адсорбции и активированной диффузии и др. Ввиду этого давно уже возникла необходимость в объединении ряда разделов химии, общностью которых являются особенности твердого состояния. Эту новую расширенную область теперь называют химией твердого состояния.
В свете задачи, решаемой в настоящей книге, - проследить эволюцию взглядов на основные законы химии, область твердого состояния представляет исключительный интерес. Почти все ее основные положения не укладываются в рамки классических законов. Здесь мы рассмотрим наиболее важные из них.
1. Носителем свойств "вещества в твердом состоянии или, иначе, формой существования химического соединения в твердом состоянии, как правило, является не молекула, а реальный монокристалл. В процессе химических реакций с участием твердого тела монокристалл выступает как единая квантово-механическая система.
Даже в тех случаях, когда кристаллы имеют молекулярную решетку, их молекулы «возмущены» и обладают существенно иными энергиями химических связей в сравнении с газовым строением, что сказывается на энергии активации реакций.
2. Посредством структурного анализа, а также методов электронного парамагнитного резонанса установлено, что многие монокристаллы являются носителями свободных валентностей, т.е. представляют собою как бы резервуары свободных радикалов, при обычных температурных условиях. Как известно, это явление не xapaктepнo для газовых и жидких систем.
3. Законы постоянства состава и простых кратных отношений для твердых тел или вовсе неприменимы, или применимы с известной условностью и относительностью.
Как показано в разделах 3 и 4 этой главы, все твердые соединения бертоллидного типа этим законам не подчиняются. Сюда относятся интерметаллические соединения, гидриды, окислы, карбиды, нитриды, сульфиды и другие соединения переменного состава.
Однако, строго говоря, этим законам не подчиняются и кристаллы «стехиометрического» состава. Любой чистый стехиометрический кристалл, находящийся в тепловом равновесии при температуре выше 00 К, обязательно содержит дефекты решетки: а) «дефекты Френкеля» - перемещение катиона или аниона из нормального положения в междоузлие и б) «дефекты Шоттки» - анионные и катионные вакансии в узлах, присутствующие в равном числе. Внутри монокристалла эти дефекты могут не изменять стехиометрического состава, так как имеет место компенсация вaкансии с атомом в междоузлии при дефектах Фрeнкеля и разнозаряженных ванансий при дефектах Шоттки. В приповерхностной же части кристалла компенсации нарушаются, а вместе с этим перестает соблюдаться и стехиометрия состава. Отклонения от стехиометрии могут происходить, далее, вследствие наличия вакансий в решетке одного из компонентов. При ионном строении кристаллов требование электронейтральности при этом соблюдается путем компенсации избытка или недостатка ионов соответствующим избытком или недостатком электронов. Естественно, электронные, а следовательно, и химические свойства кристаллов в таких случаях сильно изменяются. Так как различий в отклонениях от стехиометрии бывает довольно много, в настоящее время их стали классифицировать, во-первых, на большие и малые отклонения, а во-вторых, на четыре главных типа нестехиометрии: 1) соединения с избытком металла вследствие анионных вакансий; 2) соединения с избытком металла при наличии катионов в междоузлиях; 3) соединения с избытком электроотрицательного компонента при наличии aнионов в междоузлиях; 4) соединения с избытком электроотрицательного компонента при наличии катионных вакансий. Примеров этому великое множество. Установлено даже, что отдельные соединения обладают тенденцией иметь именно определенный из этих эффектов. Закись никеля, например, приготовленная при температурах ниже 5000 С, содержит больше кислорода, а окись цинка - больше металла. 3акись меди тоже содержит больше кислорода. Поэтому такие соединения имеют брутто-формулы с некоторым отклонением от NiO, ZnO, CuO2 и т. д.
Иногда отклонения бывают очень незначительными, и их нельзя обнаружить методами химического анализа. В таких случаях прибегают к определению полупроводниковых свойств, что в сочетании с теорией дает возможность определить степень и природу нестехиометричности.
Наряду с дефектами Френкеля и Шоттки реальные кристаллы обладают линейными дефектами структуры - дислокациями, образующимися в процессе роста или деформации.
Наличие дефектов решетки и дислокаций в реальных кристаллах сказывается на всех свойствах твердого вещества: физических (оптических, полупроводниковых, магнитных и т. д.) и химических. Важнейшим достижением химии твердого состояния являются представления о миграции дефектов решетки в процессе реакций твердого тела с реагентами любого агрегатного состояния.
4. Следствием наличия дефектов и дислокаций в реальных кристаллах является не только отклонение от стехиометрии, т. е. не подчинение законам постоянства состава и кратных отношений, но и неподчинение законам, валентности. Кроме того, отсутствие молекул даже в «идеальных» кристаллах ионного и металлического типа вообще приводит к иным, в сравнении с веществами в газообразном состоянии, валентным отношениям. Вместо обычной для большинства нециклических молекул двухцентровой валентной связи здесь на первый план выступают многоцентровые связи, определяемые координационными числами компонентов через количество ближайших к данному атому соседних атомов.
Поэтому, например, для перовскита, СаТiО3, нельзя употреблять структурную формулу 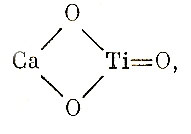 ибо кальций в перовските связан не с двумя, а с двадцатью атомами кислорода, а титан связан тремя равнозначными связями с кислородом; и нет оснований полагать, что между Са и Т нет взаимодействия через электронный субстрат. Для селенида таллия (TlSe ) тоже нельзя написать формулу Тl = Se, так как одна половина aтомов таллия находится в крупных восьмивершинниках, а вторая половина – в тетраэдрах решетки. Соответственно этому условно принимают, что ближе всего идеальному селениду таллия отвечала бы брутто-формула Ti+Ti3+Se22-.
ибо кальций в перовските связан не с двумя, а с двадцатью атомами кислорода, а титан связан тремя равнозначными связями с кислородом; и нет оснований полагать, что между Са и Т нет взаимодействия через электронный субстрат. Для селенида таллия (TlSe ) тоже нельзя написать формулу Тl = Se, так как одна половина aтомов таллия находится в крупных восьмивершинниках, а вторая половина – в тетраэдрах решетки. Соответственно этому условно принимают, что ближе всего идеальному селениду таллия отвечала бы брутто-формула Ti+Ti3+Se22-.
5. Не только реальный, но и идеальный кристалл стехиометрических соединений ионного и металлического типа с брутто-формулой АnВm, АnBmCp и т. п. по существу не отвечает закону постоянства состава, так как имеет переменную величину х: (АnВm)х, (АnBmCp)х. Это значит, что в отличие от соединений с насыщенными молекулами кристалл всегда способен к реакциям присоединения, если под последними иметь в виду рост кристалла и хемосорбцию тех реагентов, которые способны насытить остаточные валентные возможности.
В заключение можно сказать, что химия твердого состояния - это преимущественно химия бертоллидов в самом широком смысле этого слова, т.е. химия нестехиометрических отнгошений.
Выводы:
Как следует из содержания настоящей темы, параллельно развитию атомно-молекулярного учения, представлявшему магистральное направление развития всей химии, происходило также постепенное накопление фантастических данных, не укладывающихся в рамки стехиометрических законов:
1. Углубленное изучение химии растворов и сплавов привело к непреложному выводу о существовании наряду с химическими соединениями постоянного состава - дальтонидами химических соединений переменного состава - бертоллидов. Исследование природы бертоллидов и их отношение к дальтонидам показало, что соединений переменного состава очень много; они распространены не меньше, чем дальтониды. Оказалась, что не только химия растворов, но и химия твердого состояния - это все сплошь область соединений бертоллидного типа.
2. Уже начиная с исследований Д. И. Менделеева, а в особенности Н. С. Курнанова, положивших начало применению физических методов изучения химических превращений, основные задачи химии становятся существенно отличными от тех, которые решались в период возникновения атомно-молекулярного учения. Химия начинает обращаться, хотя еще и робко и не очень эффективно, к непосредственному изучению химических процессов. С дальнейшим внедрением в химические исследования физических методов имия все более и более становится наукой не только о веществе, но и о процессах изменения вещества. Вместе с этим все более начинают выявляться роль непрерывных отношений в химии, а также роль непрерывной формы химической организации вещества, т. е. соединений переменного состава, бертоллидов.
Дата добавления: 2016-05-30; просмотров: 2487;











