Механизмы экотоксичности
По-видимому, в каждой экосистеме механизмы экотоксичности могут быть уникальны. В общем, можно выделить прямое, опосредованное и смешанное действие экотоксикантов.
Прямое действие - это непосредственное поражение организмов определенной популяции или нескольких популяций (биоценоза) экотоксикантом или совокупностью экотоксикантов данного ксенобиотического профиля среды. Примером веществ с подобным механизмом действия на человека является кадмий. Этот металл накапливается в организме даже при минимальном его содержании в среде и при достижении критической концентрации инициирует токсический процесс.
Опосредованное - это действие ксенобиотического профиля среды на биотические или абиотические элементы среды обитания популяции, в результате которого условия и ресурсы среды перестают быть оптимальными для её существования.
Многие токсиканты способны оказывать как прямое, так и опосредованное, т.е. смешанное действие. Примером веществ, обладающих смешанным механизмом экотоксического действия, являются в частности гербициды 2,4,5-Т и 2,4-Д, содержащие в качестве примеси небольшое количество 2,3,7,8-тетрахлордибензо-р-диоксин (ТХДД).
В современной литературе приводятся многочисленные примеры механизмов действия химических веществ на живую природу, позволяющие оценить их сложность и неожиданность. Рассмотрим некоторые из них.
1.Прямое действие токсикантов, приводящее к массовой гибели представителей чувствительных видов. Применение эффективных пестицидов приводит к массовой гибели вредителей: насекомых (инсектициды) или сорняков (гербициды). На этом экотоксическом эффекте строится стратегия использование химикатов. Однако в ряде случаев отмечаются сопутствующие негативные явления. Так в Швеции, в 1950-1960 гг. для обработки семян зерновых культур широко использовали метилртутьдицианамид. Концентрация ртути в зерне составляла более 10 мг/кг. Периодическое склевывание протравленного семенного зерна птицами привело к тому, что через несколько лет была отмечена массовая гибель фазанов, голубей, куропаток и других зерноядных пернатых от хронической интоксикации ртутью.
При оценке экологической обстановки необходимо иметь в виду основной закон токсикологии: чувствительность различных видов живых организмов к химическим веществам всегда различна. Поэтому появление поллютанта в окружающей среде даже в малых количествах может быть пагубным для представителей наиболее чувствительного вида. Так, хлорид свинца убивает дафний в течение суток при содержании его в воде в концентрации около 0,01 мг/л, малоопасной для представителей других видов.
2. Прямое действие ксенобиотика, приводящее к развитию аллобиотических состояний и специальных форм токсического процесса. В конце 80-х годов в результате вирусных инфекций в Балтийском, Северном и Ирландском морях погибло около 18 тысяч тюленей. В тканях погибших животных находили высокое содержание полихлорированных бифенилов (ПХБ). Известно, что ПХБ, как и другие хлорсодержащие соединения, такие как ДДТ, гексахлорбензол, диелдрин обладают иммуносупрессивным действием на млекопитающих. Их накопление в организме и привело к снижению резистентности тюленей к инфекции. Таким образом, непосредственно не вызывая гибели животных, поллютант существенно повышал их чувствительность к действию других неблагоприятных экологических факторов. Классическим примером данной формы экотоксического действия является увеличение числа новообразований, снижение репродуктивных возможностей в популяциях людей, проживающих в регионах, загрязненных экотоксикантами, например на территории Южного Вьетнама, загрязненного - диоксинами.
3. Эмбриотоксическое действие экополлютантов. Хорошо установлено, что ДДТ, накапливаясь в тканях птиц, таких как кряква, скопа, белоголовый орлан и др., приводит к истончению скорлупы яиц. В итоге птенцы не могут быть высижены и погибают. Это сопровождается снижением численности популяции птиц. Примеры токсического действия различных ксенобиотиков (в том числе лекарственных препаратов) на эмбрионы человека и млекопитающих широко известны.
4. Прямое действие продукта биотрансформации поллютанта с необычным эффектом. Полевые наблюдения за живородящими рыбами (карпозубые) в штате Флорида позволили выявить популяции с большим количеством самок с явными признаками маскулинизации (своеобразное поведение, модификация анального плавника и т.д.). Эти популяции были обнаружены в реке, ниже стока завода по переработке орехов. Первоначально предположили, что стоки содержат маскулинизирующие вещества. Однако исследования показали, что такие вещества в выбросах отсутствуют: сточная вода не вызывала маскулинизацию. Далее было установлено, что в сточных водах содержался фитостерон, (образуется в процессе переработки сырья), который попав в воду реки подвергался воздействию обитающих здесь бактерий и превращался при их участии в андроген. Последний и вызывал неблагоприятный эффект (рис. 5.2).
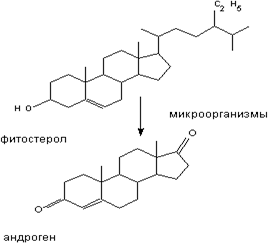
Рисунок 5.2. Превращение фитостерола в андроген при участии микроорганизмов.
Таким образом, взаимодействие ксенобиотика с биотическим компонентом среды (микроорганизмы) может стать причиной существенных популяционных эффектов в биоценозе.
5. Опосредованное действие путем сокращения пищевых ресурсов среды обитания. Для борьбы с вредителями лесного хозяйства, гусеницами елового листовертки-почкоеда в одном из регионов Канады применили фосфорорганический пестицид, быстро деградирующий в среде. В результате резкого снижения числа гусениц от бескормицы погибло около 12 млн птиц.
6. Взрыв численности популяции вследствие уничтожения вида-конкурента. В США после начала применения синтетических пестицидов для борьбы с некоторыми видами вредителей растений стали интенсивно размножаться малочисленные ранее виды клещей-хлопкоедов. Количество опасных видов таких клещей увеличилось с 6 до 16. Это явление объясняют тем, что в мире насекомых существует сложная система взаимоотношений, и количество особей в популяции растительноядных насекомых зачастую контролируется другими видами, которые либо паразитируют на этих насекомых, либо ведут себя по отношению к ним как хищники. Воздействие пестицидов может оказаться более выраженным на представителей видов-хищников. В итоге - гибель врагов приводит к взрыву численности растительноядных насекомых.
Нетрудно заметить, что приведенные в качестве примеров механизмы экотоксического действия веществ на животных при иных условиях вполне могут реализоваться и в отношении человека.
ПРАКТИЧЕСКИЕ РАБОТЫ ПО КУРСУ «ЭКОЛОГИЧЕСКАЯ ТОКСИКОЛОГИЯ»
Практическая работа №1.Токсикометрическая оценка биологической активности токсикантов
Задание: Ознакомьтесь с теоретической частью, разберите алгоритм оценки токсичности вещества по Спирмену — Керберу. С измененными данными показателя «Число погибших животных» (табл.1) рассчитайте генеральную среднюю дозу эффекта LD50.
Теоретическая часть. При испытании инсектицидов, лекарственных, радиоактивных и других биологически активных веществ обнаруживается, что особи однородной группы реагируют на одну и ту же дозу по-разному, (т.е. имеет место индивидуальная изменчивость) и что разные дозы могут вызывать одинаковый эффект у целой группы индивидов. Отсюда следует, что о силе действия на организм биологически активных веществ можно судить лишь по среднему результату.
Дозы сильнодействующих веществ испытывают на однородных группах (мыши, крысы и другие объекты) по 6 - 10 особей в группе. На каждой группе изучают одну дозу. Обычно применяют 5 - 9 доз в возрастающем по силе действия порядке. Опыт проводят одновременно на всех группах особей. При этом учитывают число особей, у которых обнаружился эффект, и число тех, у которых видимого эффекта от действия доз не обнаружено. О среднем результате судят по обнаружению эффекта действия доз у 50% подопытных индивидов.
Определить дозу, вызвавшую видимый эффект или летальный исход у 50% подопытных индивидов, можно разными способами - графически и аналитически. Установлено, что индивидуальные реакции подопытных животных на воздействие биологически активных веществ распределяются, как правило, нормально. Зависимость между дозой и эффектом действия графически выражается в виде S-образной кривой, или кумуляты. Кумулята, называемая кривой эффекта доз, может быть получена, если по оси абсцисс откладывают дозы вещества, а по оси ординат - эффект воздействия этих доз на подопытных животных. Центральная точка кумуляты совпадает с центром распределения. Опуская из этой точки перпендикуляры на оси координат, можно определить среднюю дозу эффекта. Проще, однако, среднюю дозу эффекта определить аналитическими способами, один из которых рассматривается далее.
Способ Спирмена — Кербера.Достоинство этого способа заключается в том, что он позволяет не только рассчитать среднюю дозу эффекта M, но и построить доверительный интервал для генеральной средней µ. Среднюю дозу эффекта определяют по формуле:
M = m - d (P1-0.5), (1)
где m — минимальная доза, вызывающая эффект у 100% подопытных индивидов; d— разница между дозами; Р1 — суммарная доля реагирующих на дозы индивидов.
Среднее квадратическое отклонение вычисляют по следующей формуле:
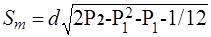 ….. (2)
….. (2)
Здесь Р2— сумма ряда накопленных долей реагирующих на дозы индивидов.
Пример. На группе, состоящей из десяти лабораторных мышей, испытывали действие ядовитого вещества. Дозы яда рассчитывали в миллиграммах на 1 кг массы тела подопытных животных. Эффект действия яда учитывали по летальным исходам. Результаты опыта приведены в таблице.
В данном случае n=10, d=10, m=180 мг/кг, Р1=4,0 и Р2=11,8. Подставляем известные величины в формулы (1) и (2): m=LD50=180-10(4,0-0,5)=180-35=145 мг/кг, получаем Sm =18.75.
Найденные величины m=145 и Sm = 18,75 позволяют построить доверительный интервал для генерального параметра, т. е. истинной средней дозы эффекта: m± 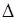 m, где
m, где 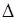 m =tSm — величина предельной ошибки средней m.
m =tSm — величина предельной ошибки средней m.
В данном случае Sm = Sm/ 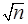 = 18,75/
= 18,75/ 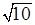 = 18,75/3,16 = 5,93. Отсюда для 5%-ного уровня значимости и соответственно t=1,96 нижняя граница доверительного интервала составляет
= 18,75/3,16 = 5,93. Отсюда для 5%-ного уровня значимости и соответственно t=1,96 нижняя граница доверительного интервала составляет
145 - 1,96 • 5,93= 145 - 11,62=133,38~133 мг/кг и верхняя граница 145+11,62=156,62~157 мг/кг.
Это означает, что с вероятностью Р = 0,95 можно утверждать, что генеральная средняя доза эффекта LD50находится в пределах от 133 до 157 мг/кг.
Таблица 1. Результаты опытов, используемые при расчетах
| Доза, мг/кг | Сумма | ||||||||
| Число погибших животных | - | ||||||||
| Доля погибших животных | 0,1 | 0,3 | 0,4 | 0,6 | 0,7 | 0,9 | 1,0 | 4,0 |
Продолжение таблицы 1
| Накопленная доля погибших животных | 0,1 | 0,4 | 0,8 | 1,4 | 2,1 | 3,0 | 4,0 | 11,8 |
Практическая работа №2. Типы химических связей, образующихся между токсикантами и молекулами-мишенями организма
Задание: 1.Ознакомиться с типами химической связи. 2.Сделать краткий конспект, содержащий характеристики типов связей и рисунки. 3.Сравнить химические связи по прочности и сделать выводы о токсичности веществ, обладающих различными типами связей. 4. Определить, согласно степени прочности характер процесса детоксикации организма.
При взаимодействии токсиканта с биологическими структурами-мишенями могут образовываться различные типы химических связей (табл. 1).
Таблица 1. различные типы связей, формирующихся между токсикантами и молекулами-мишенями организма
| Вид связи | Пример | Энергия связи (кдж/мол) |
| Ионная | 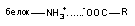
| |
| Ковалентная | 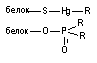
| 40 - 600 |
| Донорно-акцепторная | 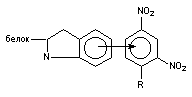
| 4 – 20 |
| Ион-дипольная | 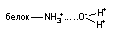
| 8 – 20 |
| Диполь-дипольная | 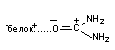
| 4 – 12 |
| Водородная | 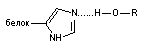
| 4 – 28 |
| Ван-дер-Ваальса | 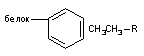
| 1 – 4 |
| Гидрофобная | 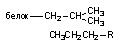
| 1 – 6 |
Ионная связь. В водных растворах многие вещества диссоциируют с образованием ионов. Между положительно и отрицательно заряженными ионами токсиканта и эндогенными ионами-мишенями начинают действовать силы электростатического притяжения. Вследствие притяжения возникает химическая связь. Связь такого типа называется электровалентной или ионной. Образованные катионами и анионами вещества не несут электрического заряда.
А- + В+  АВ
АВ
Токсические последствия подобного взаимодействия в организме развиваются в случае образования не растворимого в воде комплекса иона-токсиканта с биологически значимым ионом-мишенью. Например, при интоксикации фторидами, ион фтора может вступать во взаимодействие с ионом кальция. В итоге образуется нерастворимый фторид кальция. Развивающаяся гипокальциемия имеет определенное значение для развития и проявления интоксикации. Аналогичным образом действует щавелевая кислота, образующаяся в организме в процессе метаболизма этиленгликоля при интоксикации последним:
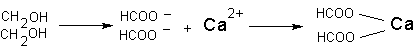
Поскольку степень диссоциации многих веществ в водном растворе существенно зависит от рН среды, количество образовавшихся за счет ионной связи комплексов токсикант-мишень также зависит от этого показателя.
Ковалентная связь. Для образования ковалентной связи, взаимодействующие атомы должны иметь на внешней электронной орбите неспаренные электроны. Эти электроны занимают одну и ту же орбиталь, а образовавшаяся общая пара формирует силу притяжения между атомами. В результате образования такой общей пары электронов каждый из взаимодействующих атомов приобретает "завершенный набор" электронов и образовавшееся соединение становится стабильным. Энергия ковалентной связи велика и составляет 200 - 400 кдж/мол
Высокая стабильность связи этого типа означает практически необратимый характер присоединения токсиканта к структуре-мишени. Примерами веществ, образующих с биомолекулами подобную связь, являются ФОС (взаимодействуют с серином, входящим в структуру активного центра ацетилхолинэстеразы), иприты (взаимодействуют с пуриновыми основаниями нуклеиеновых кислот), а также целый ряд других распространённых токсикантов (метилбромид, метилхлорид, этиленоксид и др.). Вследствие прочности образовавшейся связи, разрушение комплекса токсикант-биомишень возможно только с помощью специальных средств (например, реактиваторов ХЭ при интоксикации ФОС). Восполнение содержания поврежденной токсикантом биологической структуры возможно также за счет синтеза её de novo. Так, восстановление активности АХЭ в тканях лабораторных животных отравленных зоманом проходит со скоростью синтеза энзима нервными клетками.
Координационная связь- это ковалентная связь, в которой обобществленною пару электронов предоставляет только один из участвующих в связи атомов. Один из атомов является донором, а другой акцептором электронной пары, поэтому эту связь называют также донорно-акцепторной. Акцепторами часто являются катионы металлов, или атомы переходных металлов (Zn, Cu, Fe), входящих в состав молекулы. Таким образом, в частности, оксид углерода взаимодействует с железом гемоглобина, с образование карбоксигемоглобина.
Водородная связь. Ковалентная связь между атомом водорода и электроотрицательным атомом (кислород, азот, сера и т.д.) более или менее поляризована
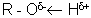
Вследствие этого атом водорода приобретает незначительный положительный заряд. Если в близи такого атома находится молекула или группа, содержащая анион или электроотрицательный атом, между ними образуется слабая связь, называемая водородной.
Водородная связь может образовываться как между молекулами, так и между атомами внутри молекул. Энергия связи не велика и в водном растворе составляет около 20 кдж/мол. Её прочность во многом зависит от строения взаимодействующих веществ, в частности, от степени электроотрицательности атомов, связанных с водородом. Электроотрицательность атомов возрастает в ряду:
Н = P < C = S = I < Br < Cl = N < O < F
2,1 2,1 2,5 2,5 2,5 2,8 3,0 3,0 3,4 4,0
Водородные связи имеют очень большое значение для поддержания пространственной структуры белков, нуклеиновых кислот и других высокомолекулярных соединений. Вещества, способные разрушать водородную связь, могут нарушать пространственную структуру макромолекул (явление интерколации: встраивание молекул акридина, этидиумбромида между плоскостями, образуемыми витками спирали молекулы ДНК).
В состав молекул токсикантов также входят группы, способные участвовать в образовании водородных связей. Если эти группы (Х-Н) являются структурными элементами "активного" радикала токсиканта, то они участвуют в образовании сложной связи вещества с молекулой-мишенью. Поскольку водородные связи являются по сути электростатическими, их сила ослабевает в присутствии веществ, обладающих свойствами диэлектриков ("неэлектролитов").
Связи Ван-дер-Ваальса. Форма электронного облака молекул квазистабильна, то есть не изменяется до тех пор, пока на неё не действуют внешние силы. Под влиянием электромагнитных полей электронные облака молекул деформируются. При этом безразлично вызвано ли появление деформируящих сил воздействием внешних полей или поле сформировано близлежащими ионами, диполями, аполярными молекулами. Степень деформированности электронного облака зависит от энергетических характеристик воздействующих полей и поляризуемости самой молекулы. Способность электронного облака к деформации (поляризуемость) зависит от размеров молекулы. У больших молекул она больше, чем у малых, поскольку сместить электроны, находящиеся на значительном удалении от ядра атома, легче.
Деформирующее воздействие полей превращает неполярные молекулы в диполи, так как центры максимальной плотности положительного и отрицательного зарядов молекулы несколько разъединяются в пространстве. Сформировавшийся диполь называют индуцированным или временным, поскольку он перестает существовать сразу после прекращения действия деформирующих сил. Две близлежащие неполярные молекулы могут взаимно индуцировать образование временных диполей и, таким образом взаимодействовать друг с другом. Силы взаимодействия, формирующиеся между временными диполями, называются силами Лондона - Ван-дер-Ваальса. Энергия образующейся связи мала, однако она существенно возрастает при увеличении числа участков контакта между взаимодействующими молекулами. Со стороны токсиканта это могут быть ароматические, гетероциклические, алкильные радикалы; со стороны рецептора - неполярные участки молекул аминокислот (лейцин, валин, аланин, пролин и др.). Вклад каждой -СН2- группы алкильной цепи во взаимодействие оценивается в 2 - 4 кдж/мол. При тесном контакте больших неполярных молекул энергия связи может достичь очень больших величин. Поэтому при образовании комплекса токсикант-биомишень силы Ван-дер-Ваальса могут обеспечивать очень прочную фиксацию ксенобиотика. Действующая сила, ответственная за формирование связи, обратно пропорциональна седьмой степени расстояния между взаимодействующими молекулами. Поэтому она не может обеспечить притяжение молекул токсиканта, свободно циркулирующих в биосредах, к рецептору. В этом процессе первостепенную роль играют силы электростатического взаимодействия. Однако после того как контакт между токсикантом и рецептором осуществился силы Ван-дер-Ваальса обеспечивают его ориентацию и плотную фиксацию.
Гидрофобное взаимодействие. Гидрофобные связи формируются в водной среде, когда молекулы взаимодействующих веществ контактируют друг с другом неполярными (гидрофобными) участками. В отличии от взаимодействия Ван-дер-Ваальса и донорно-акцепторного взаимодействия, которые также формируются при взаимодействии неполярных групп, образование гидрофобных связей обусловлено свойствами воды, без участия которой взаимодействие происходить не может. В соответствии с теорией, молекулы воды связаны друг с другом водородными связями, образуя трехмерную структуру (кластер), напоминающую структуру льда. На границе поверхности, разделяющей неполярную молекулу и молекулы воды, образование такой структуры затрудняется. При контакте двух неполярных молекул, растворенных в воде, общая площадь поверхности, разделяющей воду и эти молекулы, уменьшается. Вследствие этого, мобилизуется часть молекул воды, организованных в кластер. В противоположность всем другим химическим связям и взаимодействиям гидрофобная связь, таким образом, обусловлена преобразованием растворителя (воды), а не растворенных взаимодействующих веществ. Движущей силой образования связи является рост энтропии целостной системы растворитель - растворенные молекулы. Структурная организация гидрофобных, взаимодействующих молекул возрастает (уменьшение энтропии), но при этом существенно дезорганизуется (энтропия возрастает) структура растворителя (воды).
Гидрофобные связи имеют большое значение при взаимодействии неполярных молекул ксенобиотиков с клеточными и внутриклеточными мембранами, для образования их комплексов с белками, при этом возможно нарушение конформации макромолекул.
В процессе взаимодействия низкомолекулярного вещества с биомишенью практически всегда формируется несколько типов связей, поскольку молекула токсиканта, как правило, включает полярный (иногда даже ионизированный), и неполярный фрагменты.
Ионные связи, за счет которых осуществляется притяжение молекулы к биомишени, мало специфичны (аналогично ион-дипольному и диполь-дипольному взаимодействию). Взаимодействие между неполярными группами также неспецифично. Однако, если в структуре мишени (например, рецепторе для эндогенных биорегуляторов) полярные и неполярные группы пространственно организованы, между этими участками и особыми участками молекулы токсиканта образуются специфичные связи, обусловленные пространственной организацией молекулы токсиканта. Такое взаимодействие можно сравнить с ориентацией намагниченых стрелок в магнитном поле. После ориентации молекулы с помощью ионного (диполь-дипольного) взаимодействия между ней и рецептором формируется тесный контакт, и образуются связи за счет водородных сил и сил Ван-дер-Ваальса. Образующийся комплекс тем более прочен, чем более комплементарна молекула токсиканта рецептору.
Практическая работа №3.Исследование запыленности воздуха
Задание:1. Определите относительную запыленность воздуха. 2. Оцените качественный состав пыли.3. Оцените экологическое состояние помещения.
Материалы, реактивы, оборудование:1. Вода дистиллированная. 2. Растворы азотной и соляной кислот (10%). 3, Весы аналитические. 4. Лопатка для отбора образцов отложений пыли. 4. Микроскоп с объективом «х8» (восьмикратное увеличение), 5. Пипетка, покровные и предметные стекла для микроскопа.
Ход работы к заданию 1. На 3 предметных стекла нанесите по 1 капле воды, Установите их в местах, указанных преподавателем, на 15 мин. По истечении этого срока накройте капли с осевшими пылинками покровными стеклами, приготовив, таким образом микропрепараты.
Поместите микропрепарат на предметный столик микроскопа. Добейтесь увеличения, при котором в поле зрения помещается наибольшая часть капли. Сосчитайте количество пылинок в капле, зарисуйте и опишите их качественный состав (вид, структуру, взаимное расположение, особенности строения).
Варианты выбора условий отбора проб пыли:при открытой и закрытой форточке; в разных помещениях: в аудитории, в коридоре; за пределами помещения: на стройке, в парке, вблизи автомобильной или железной дороги; на разной высоте от пола: 20см, 1м, 1,5м.
Ход работы к заданию 2.Образец сухой пыли соберите из отложения лопаткой (с участка в 3-5 см) и поместите на предметное стекло. Приготовьте микропрепарат сухой пыли, накрыв образец покровным стеклом. Поместите микропрепарат на предметный столик микроскопа. Добейтесь увеличения, при котором в поле зрения помещается наибольшая часть образца.
Рассмотрите микропрепарат в микроскоп и опишите, из чего состоит пыль (вид, форма, размеры, взаимное расположение, цвет частиц).
Поднимите препаровальной иглой покровное стекло и нанесите на образец пыли каплю азотной или соляной кислоты. Сразу верните на место покровное стекло. Имея в виду, что соляная кислота растворяет частицы известняковых пород и водорастворимые соли, а азотная - и эти, и большинство других минеральных солей, рассмотрите препарат и сделайте вывод о произошедших изменениях.
Проанализируйте полученные результаты и сделайте выводы о качественном составе пыли, об относительной запыленности воздуха в разных точках объекта обследования. Оцените экологическое состояние помещения, пользуясь сведениями из приведенной ниже таблицы 1.
Таблица 1. Предельно допустимые концентрации
для взвешенных веществ (пылей) различной природы
| Тип вещества | ПДК (среднесуточная), мг/мэ |
| Пыль, не идентифицированная по составу | 0,015 |
| Неорганические вещества | |
| Хлорид натрия | 0,15 |
| Фосфоцементная пыль | 0,5 |
Продолжение таблицы 1.
| Цемент | 0,02 |
| Сажа | 0,05| |
| Свинец и его соединения | 0,0003 |
| Угольная зола ТЭЦ (щелочная, мелкодисперсная) | 0,02 |
| Органические вещества, препараты бытовой химии | |
| Текстолит | 0,04 |
| Чистящее средство "Пемолюкс" | 0,02 |
| CMC типа "Кристалл" (по алкилсульфонату натрия) ннатриянатрия) | 0,01 |
| Биогенные вещества | |
| Белок пыли витаминно-белкового концентрата | 0,001 |
| Комбикорм | 0,01 |
| Хлопок | 0,05 |
| Углеродные волокнистые материалы | 0,05 |
Лабораторная работа №1. Определение содержания нитритов и нитратов в пищевых продуктах
Задание:1.Ознакомьтесьс понятием «нитратные загрязнения», сделайте краткий конспект. 2. Измерьте уровень загрязнения пищевых продуктов нитратами. 3. Сравните полученные результаты с предложенными теоретически и сделайте соответствующие выводы.
Материалы и оборудование: нитромер, набор пищевых продуктов (овощи, фрукты), скальпель.
Теоретическая часть. Проблема содержания нитратов в продуктах в настоящее время актуальна. Производство удобрений составляет сейчас около 23 кг в год на человека, причем половина всех удобрений содержат соединения азота.
Азот — элемент, который стимулирует рост растений, влияет на качество плодов и содержание в них белка. Органические, и минеральные удобрения, содержащие соединения азота, в почве превращаются в нитраты (NO3), вместе с водой поступающие в растения. В корневой системе, стеблях, листьях, плодах нитраты восстанавливаются под воздействием ферментов до иона аммония NH4+, который становится основой аминокислот и далее — белков. То есть минеральный азот превращается в безвредный органический азот — компонент природных соединений. Когда же удобрений поступает слишком много, растения не справляются с их переработкой, и нитраты скапливаются в плодах, попадающих к нам на стол.
Нитраты и нитриты используют для обработки и консервирования многих пищевых продуктов, в том числе ветчины, бекона, солонины, а также некоторых сортов сыра и рыбы.
Повышенные содержания нитратов в организме подавляют дыхание клеток, что выражается в снижении работоспособности, головокружении, потере сознания. Ученые полагают, что в организме человека нитраты превращаются в нитрозоамины, которые являются канцерогенами. Человек относительно легко переносит дозу в 150 — 200 мг нитратов в день; 500 мг - предельно допустимая доза; 600 мг в день — доза токсичная для взрослого человека, а для грудного ребенка даже 10 мг нитратов могут вызвать сильное отравление. В питьевой воде допускается до 45 мг/л нитратов.
Чтобы не допустить превышения этих доз, полезно знать некоторые правила:
- основными источниками нитратов являются растительные продукты. В незрелых овощах, а также в овощах раннего созревания нитратов больше, чем в достигших нормальной уборочной зрелости;
- внутри растения нитраты распределяются неравномерно. Например, в ранних тепличных огурцах количество нитратов от плодоножки уменьшается по длине огурца на каждый сантиметр в 1,5 — 2 раза. Больше вес го нитратов в кожице огурцов и кабачков;
- содержание нитратов связано с особенностями и специализацией отдельных органов растений: типом листьев, размером листовых черешков и жилок, диаметром центрального цилиндра в корнеплодах. У зеленых листовых овощей, например, нитраты накапливаются в основном в стеблях и черешках листьев, поскольку именно сюда идет основной транспорт соединений азота.
Самым простым способом снижения количества нитратов является очищение овощей от кожицы, не использование тех частей растения, в которых происходит максимальное накопление нитратов: например, кочерыжки в капусте, стебля петрушки.
Другой способ уменьшения количества нитратов - предварительное вымачивание овощей в водных растворах
Ход работы.Ознакомьтесь с устройством и принципами работы нитромера.
Определите количество нитратов в предложенных образцах с помощью нитромера. На основании измерений заполните таблицу 1.
По каждому измерению в соответствии с данными, приведенными в таблице 2, сделайте выводы о качественности продуктов с точки зрения содержащихся в них нитратов.
Укажите, какое количество продукта вы можете съесть, чтобы не превысить свою допустимую суточную норму нитратов, исходя из того, что допустимая суточная норма нитратов 5 мг на 1 кг веса человека. Обоснуйте свои выводы.
Таблица 1. Качество плодоовощной продукции
| Наименование образца | Показание нитромера (%, мг/кг) | Заключение о качестве продукта |
Таблица 2. Минимальные и максимальные количества нитратов в овощах (мг/кг)
| Культура | Количество нитратов (мг/кг) | |
| мин. | макс. | |
| Арбуз | ||
| Баклажаны | ||
| Брюква | ||
| Горошек зеленый | ||
| Горчица салатная | ||
| Дыня | ||
| Кабачки | ||
| Кориандр | ||
| Кресс-салат | ||
| Лук зеленый | ||
| Лук репчатый | ||
| Морковь | ||
| Огурцы | ||
| Патиссоны |
На рисунке 1 показано распределение нитратов в корнеплодах столовой свеклы, моркови, клубне картофеля и кочане капусты. Сравните результаты своих измерений и сделайте практические выводы.
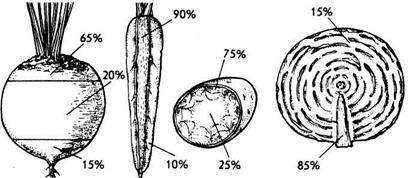
Рисунок 1. Распределение нитратов в овощах (свекле, моркови, картофеле, капусте)
Список использованной литературы:
1.Безопасность России. Правовые, социально-экономические и научно-технические аспекты. Экологическая диагностика /Под.ред. В.В. Клюева.- М.: МГФ «Знание» Машиностроение, 2000. - 495с.
2. .Келина Н.Ю. Безручко Н.В. Токсикология в таблицах и схемах. Ростов на Дону: Феникс, 2006.-142с.
3.Куценко С.А. Основы токсикологии. - СПб, 2002.- 638с.
4. Лакин Г.Ф. Биометрия: Учеб. пособие для биол. спец. вузов – 4-е изд., перераб. И доп. – М.: Высш.шк.., 1990.- 352с.
5.Лукашевич О.Д., Колбек М.В. Практические работы по экологии и охране окружающей среды. Методическое пособие. – Томск: Изд-во Томского государственного архитектурно-строительного университета, 2004.-81с.
6.Незнамова Е.Г. Пространственно-временная структура лесных сообществ мелких млекопитающих Томского Приобья автореф. дисс. на соиск. уч.ст. к.б.н._ Томск –2003.-20с.
7. Розанов С.И. Общая экология: Учебник для техн направлений и специальностей. 3-е изд., стер.- СПб.: Изд-во «Лань», 2003.-288с.
8. Саноцкий И. В. Концепция пороговости реакций живых систем на внешние воздействия и ее следствия в проблеме противохимической защиты биосферы//Всесторонний анализ окружающей природной среды. Труды 1 советско-американского симпозиума.- Л.: Гидрометеоиздат, 1975.
9.Стадницкий Г. В., Родионов А. И. – Экология. – М.: «Высш. шк.» – 1988г.
10. Тупикин Е.И. Общая биология с основами экологии и природоохранной деятельности: Учеб. пособие для сред. профобразования.- 4-е изд., испр. и доп.- М.: Издательский центр «Академия», 2004.-384с.
11. Хотунцев Ю.Л. Экология и экологическая безопастность: Учеб. Пособие для студ. Высш. пед. учеб. заведений.- М.: Изд.центр «Академия», 2002.-480с.
Дата добавления: 2020-10-01; просмотров: 1000;











