ПРОМЫШЛЕННЫЕ ПРОЦЕССЫ С ИСПОЛЬЗОВАНИЕМ ИММОБИЛИЗОВАННЫХ ФЕРМЕНТОВ И КЛЕТОК
Сочетание уникальных каталитических свойств энзимов с преимуществами иммобилизованных ферментов и клеток как гетерогенных катализаторов позволило создать новые промышленные технологические процессы. Следует отметить, что почти все они относятся к производству пищевых продуктов и лекарственных препаратов.
В настоящее время в мире разработаны следующие крупномасштабные производства с использованием иммобилизованных ферментов и клеток:
1. Получение глюкозофруктозных сиропов.
2. Получение оптически активных L-аминокислот из их рацемических
смесей.
3. Синтез L-аспарагиновой кислоты из фумарата аммония.
4. Синтез L-аланина из L-аспарагиновой кислоты.
5. Синтез L-яблочной кислоты из фумаровой кислоты.
6. Получение безлактозного молока.
7. Получение сахаров из молочной сыворотки.
8. Получение 6-аминопенициллановой кислоты.
В качестве примера рассмотрим некоторые из них.
1. Получение глюкозофруктозных сиропов.Фруктоза (фруктовый, плодовый или медовый сахар) - важнейший в физиологическом и технологическом отношении природный моносахарид. Превращаясь в печени и кишечнике млекопитающих в глюкозу, фруктоза включается в пластический и энергетический обмен клетки. Она в 2,5 раза слаще глюкозы и в 1,7 раза слаще тростникового сахара (сахароза), благодаря чему фруктоза - менее калорийный пищевой продукт по сравнению с последними. В отличие от глюкозы обмен фруктозы не контролируется инсулином, поэтому фруктозный сахар может потребляться больными диабетом. Фруктоза практически не вызывает кариеса зубов. В смеси с глюкозой фруктоза не кристаллизуется, поэтому широко используется для производства кондитерских изделий.
Объем производства сахарозы за последние 100 лет возрос в 15 раз и составляет, по разным оценкам, 30 - 40 кг в год на человека. Однако, несмотря на явные преимущества использования фруктозы, первая промышленная установка для превращения глюкозы во фруктозу с помощью иммобилизованной глюкоизомеразы была запущена лишь в 1973 г. (компания «Клинтон Корн», США). Исходным сырьем для этого процесса служит глюкоза, которую получают при гидролизе кукурузного или картофельного крахмала в присутствии минеральных кислот. Для конструирования промышленного биокатализатора глюкозоизомеразу сорбируют на пористых неорганических носителях или ионообменных смолах. Во многих случаях используют иммобилизованные клетки разного происхождения (Aspergillus niger, A. oryzae, Streptomyces phaeochro-mogenes, S. olivaceus, S. venezuelae).Коммерческие препараты иммобилизованной глюкоизомеразы имеют вид гранул, шариков, волокон или аморфной массы. Наиболее эффективными биореакторами для получения фруктозы признаны аппараты колонного типа высотой около 5 м, в которых по сравнению с реакторами перемешивания расход фермента минимален. Производительность такого реактора варьирует от 600 до 9000 кг глюкозофруктозного сиропа на 1 кг иммобилизованного фермента в зависимости от чистоты исходного сырья, а время полуинактивации катализатора - 20 - 50 суток. Возникающий в результате каталитического процесса глюкозофруктозный сироп содержит 42 —45 % фруктозы, около 51 % глюкозы, небольшое количество олигосахаридов и по сладости соответствует инвертному сахару, получаемому при гидролизе сахарозы. Эти смеси постепенно вытесняют инвертированный сахар в промышленности и медицине. Глюкозофруктозную смесь широко применяют для производства тонизирующих напитков, консервированных фруктов, кондитерских изделий, хлеба, мороженого и пр. Экономические расчеты показали, что производство глюкозофруктозных сиропов с использованием иммобилизованной глюкоизомеразы в 1,5 раза выгоднее получения сахарозы из сахарной свеклы по традиционной технологии. Благодаря этому обстоятельству производство глюкозофруктозных сиропов в мире постоянно растет. Так, в 1980 г. 10 % потребляемого населением Японии сахара заменено на глюкозофруктозную смесь. В США эта доля к 2000 г. достигла 40%, а к 2010 г. более 50%.
2. Биотрансформация других углеводов.Кроме изомеризации углеводов, важную роль также играют процессы микробиологической окислительной и восстановительной трансформации углеводов. Окислительная трансформация представляет собой окисление полиолов, например, маннита во фруктозу или сорбита в сорбозу. Окислению подвергаются все полиолы (полиспирты), обладающие двумя вторичными гидроксилами в цис-положении, прилежащими к терминальной первичной спиртовой группе, причем окисляется атом углерода, смежный с терминальным. Окисление полиолов получило название кетогенной ферментации.
В промышленном масштабе (при использовании свободных клеток) применяются два процесса окисления полиолов: превращение глицерина в диоксиацетон и превращение D-сорбита в L-сорбозу (одна из стадий синтеза аскорбиновой кислоты).
Диоксиацетон (1.3-дигидрокси-2-пропанон) используется для обработки изделий из целлюлозных волокон для придания им несминаемости, устойчивости к стирке и прочих важных эксплуатационных свойств; сложные эфиры диоксиацетона являются репеллентами; из диоксиацетона и аминокислот синтезируют пищевые и косметические красители; производные диоксиацетона применяют как консерванты, эмульгаторы, пластификаторы, фунгициды; наконец, диоксиацетон широко используют в медицине.
Для промышленного производства диоксиацетона применяется культура Acetobacter suboxydans (НПО "Биолар"). Известны лабораторные методы реализации процесса с помощью иммобилизованных клеток (как А. suboxydans, так и Cluconobacter oxydans), когда иммобилизацию проводят в ПААГ или Са-альгинате.
Окисление D-сорбита в L-сорбозу в промышленных условиях также осуществляют с помощью клеток А. suboxydans или G. suboxydans. L-сорбозу получают с 93%-ным выходом из 15-20 %-ных растворов D-сорбита в аэробных условиях.
В лабораторных условиях окисление D-сорбита в L-сорбозу проводят с помощью бактерий, иммобилизованных включением в каррагинановый гель, а также в ПААГ. Осуществлено также окисление иммобилизованными клетками рибита и маннита в соответствующие кетоны. Следует, однако, отметить существенное снижение скорости окислительных процессов при использовании иммобилизованных в гель клеток по сравнению со свободными.
Восстановительная трансформация углеводов заключается в превращении альдоз или кетоз в полиолы. Промышленно значимым является процесс получения ксилита из ксилозы, поскольку ксилит используется в пищевой промышленности и служит заменителем сахара. Для восстановления ксилозы применяют дрожжи C.utilis, которые были иммобилизованы в ПААГ.
Еще один класс реакций, касающийся углеводов и приводящий к получению полезных продуктов, представляют гидролитические реакции. Важную роль играют следующие процессы: гидролиз лактозы, сахарозы, раффинозы и целлобиозы.
Гидролиз лактозы с получением глюкозы и галактозы и гидролиз сахарозы с получением глюкозы и фруктозы являются хорошими примерами биотехнологических процессов, основанных на использовании иммобилизованных биокатализаторов, внедренных в широком масштабе. Лактоза содержится в молоке и молочной сыворотке, причем определенная часть населения не может употреблять молоко именно из-за наличия в нем лактозы, но усваивает (без аллергических эффектов) безлактозное молоко. Гидролиз же лактозы в молочной сыворотке, содержащей около 5% лактозы в жидкой и около 75% в высушенной сыворотке, открывает новые возможности получения сахаристых веществ из нетрадиционного сырья.
Следует отметить, что технология гидролиза лактозы основана на применении иммобилизованных грибных или дрожжевых ферментов b-лактозидаз, в частности опытные и опытно-промышленные установки существуют в РФ, США, Англии, Франции. Тем не менее, уже созданы и промышленные установки для гидролиза лактозы с помощью иммобилизованных клеток, обладающих b-галактозидазной активностью. Одна из них разработана фирмой “NOVO” (Дания). В ней используются клетки Bacillus sp., иммобилизованные за счет поперечной сшивки глутаровым альдегидом. В лабораторных условиях иммобилизацию проводили с помощью адсорбции на полифениленоксиде (Caldariella acidophila), включением в ПААГ, агар, волокна коллагена (Е.alcalescens, E.coli, K.lactis, L.bulgaricus), адсорбцией на полиуретанах, стекле, поликарбонате, полистироле, хитозане (K.lactis).
Инвертный сахар (почти эквивалентную смесь глюкозы и фруктозы) получают из сахарозы с помощью иммобилизованного фермента инвертазы на уровне пилотных установок в РФ и США (компания Snam Progesty). В настоящее время существуют лабораторные разработки по получению биокатализаторов в виде иммобилизованных в ПААГ, или желатине дрожжей (S.cerevisiae), не уступающие по эффективности иммобилизованным ферментам.
Раффиноза, или галактозилсахароза, является наиболее распространенным после сахарозы олигосахаридом, встречающимся в свободном виде в сахарной свекле и других растениях (при ферментативном гидролизе раффинозы образуется галактоза и сахароза). Американская компания Great Western Sugar использовала в технологии иммобилизованный биокатализатор, представляющий собой клетки Vortierella vinacea, сшитые глутаровым альдегидом, обладающие a-галактозидазной активностью.
Гидролиз целлобиозы осуществлен иммобилизованными в Са-альгинате микроорганизмами с целлобиазной активностью. Этот биокатализатор может быть использован, например, при реализации процессов ферментативного осахаривания целлюлозы, когда гидролизат содержит целлобиозу.
К микробным продуктам, синтезируемым в больших количествах, относятся полисахариды - декстраны, леваны, маннаны, ксантаны. Декстраны продуцируются при использовании сахарозы в качестве субстрата бактериями Leuconostoc mesenteroidis, обладающими декстрансахарозной (или транс-глюкозидазной) активностью. Молекулы декстранов построены из остатков глюкозы с a-1.6-связью, имеют небольшое количество ветвлений, частично гидрализованные декстраны с молекулярной массой 40-80 тыс. служат заменителями плазмы крови, модифицированные декстраны также используются в медицине, поперечно-сшитые декстраны (сефадексы) применяются в качестве молекулярных сит для гельфильтрации.
Ксантаны - это смолы, синтезируемые Xanthamonas campestis при анаэробном росте на глюкозной среде. Ксантаны представляют собой разветвленные полимеры, состоящие из остатков глюкозы, маннозы и глюкуроновой кислоты, некоторые из которых имеют ацетильную (СН3СО) или пируватную (СН3СОСО) группы. Ксантаны добавляют ко многим пищевым продуктам в качестве загустителей и стабилизаторов, используют как красители в текстильной промышленности и полиграфии, в производстве косметических и фармацевтических препаратов, а также при бурении нефтяных скважин в качестве добавки к буровому шламу, поскольку они обладают свойствами ПАВ.
Для получения микробных полисахаридов используют, как правило, свободные клетки, однако имеется опыт применения и иммобилизованных клеток. Иммобилизацию проводят адсорбцией на полиуретане, песке, активированном угле, силохромах. Установлено, в частности, что целесообразно осуществлять синтез полисахаридов в условиях периодической смены среды (азотсодержащей и безазотистой). Введение безазотистой среды приводит к дополнительному закреплению клеток на носителе, так что они длительное время сохраняются в адсорбированном состоянии, однако, биосинтетическая активность клеток при этом снижается. При введении в реактор азотсодержащей среды сохраняется жизнеспособность клеток и восстанавливается уровень биосинтеза. В случае биосинтеза полисахаридов иммобилизация путем адсорбции более целесообразна, чем включением в гели, однако при адсорбционной иммобилизации велика вероятность десорбции клеток и смешивания их с целевым продуктом, причем в случае полисахаридов отделение целевого продукта от клеток затруднено. Поэтому метод, основанный на периодической смене сред играет в случае биосинтеза полисахаридов важную роль.
3. Получение L-аминокислот из их рацемических смесей. Наряду с микробиологическими способами важное значение имеют химические методы промышленного получения природных аминокислот, в том числе незаменимых. Однако в результате химических реакций, используемых для синтеза аминокислот, содержащих асимметрические атомы углерода, с одинаковой скоростью образуются как D-, так и L-стереоизомеры, т. е. всегда возникает рацемическая смесь. Между тем в живых клетках обмену подвергаются лишь L-аминокислоты. Разделение рацемических смесей на составляющие их оптические изомеры (представляющее труднейшую задачу) явилось первым промышленным процессом с использованием иммобилизованных ферментов. Этот процесс был осуществлен в Японии в 1969 г. (компания «Танабе Сейяку») с помощью аминоацилазы, иммобилизованной на ДЕАЕ-целлюлозе. В качестве исходных соединений в данном превращении используют N-ацилированные производные D-,L-аминокислот, получаемые с помощью химического синтеза. Вследствие своей стереоспецифичности аминоацилаза гидролизует лишь N-ацил-L-стереоизомер, отщепляя от него ацильный радикал, в результате чего растворимость образующейся L-аминокислоты резко возрастает и ее легко можно отделить от своего антипода физико-химическими методами. При нагревании оставшаяся N-ацил-D-аминокислота рацемизируется, т.е. превращается в исходную смесь, которая вновь подвергается воздействию фермента:
Аминоацилаза строго специфична к структуре только ацильной части субстрата, поэтому одна и та же установка с иммобилизованным ферментом используется для получения различных аминокислот, в том числе L-валина, L-метионина, L-фенилаланина и L-триптофана. Время полуинактивации иммобилизованного энзима составляет 65 суток; на японских предприятиях он используется без замены более 8 лет и обеспечивает снижение стоимости производства аминокислот на 40 % по сравнению с технологией, где применяются свободные молекулы фермента.
4. Получение L-аспарагиновой кислоты.Аспарагиновая кислота широко употребляется в качестве пищевой добавки (подсластитель и подкислитель). Первая в мире промышленная установка для синтеза L-аспарагиновой кислоты из получаемого химическим путем фумарата аммония была запущена в 1973 г. в Японии (фирма «Танабе Сейяку»); в ней использованы иммобилизованные в полиакриламидном геле клетки кишечной палочки Е. coli, содержащие аспартат-аммиаклиазу.
Полиакриламидный гель с иммобилизованными микробными клетками формуют в виде кубиков размером 2 - 3 мм, которыми заполняют колонку объемом 1 м3. Через колонку пропускают раствор фумарата аммония. При подкислении выходящего из колонки элюата до рН 2,8 и охлаждении до 150С из него выкристаллизовывается аспарагиновая кислота в виде препарата 100 %-ой чистоты. Процесс получения аспартата полностью автоматизирован и осуществляется в непрерывном режиме. Производительность процесса - 1700 кг чистой аспарагиновой кислоты в сутки на |реактор. Иммобилизованные клетки кишечной палочки сохраняют активность фермента на 80 % в течение 120 дней и на 50 % в течение 600 дней работы реактора, в то время как свободные клетки — всего на протяжении 10 дней с уровнем активности 25 % от исходной. В
5. Получение L-аланина.В настоящее время основной промышленный способ получения L-аланина - ферментативное декарбоксилирование L-аспарагиновой кислоты:
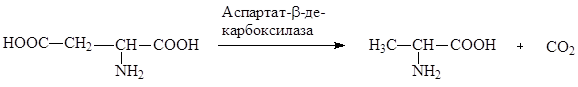
Процесс превращения L-аспартата в L-аланин катализируется аспартат-β-декарбоксилазой ряда микроорганизмов (Pseudomonas dacunhae, Alcaligenes faecalis, Achromobacter pestifier), иммобилизованных в полиакриламидном геле, каррагинане или полиуретане. Установка, разработанная японской фирмой «Танабе Сейяку», производит этим способом 10 тонн аланина в месяц. Усовершенствование процесса связано с использованием в качестве сырья фумарата аммония. В данном случае процесс получения L-аланина становится двустадийным и реализуется в двух последовательно расположенных реакционных колонках. На первом этапе фумарат аммония превращается в L-аспарагиновую кислоту, которая без выделения из реакционной среды на втором этапе претерпевает β-декарбоксилирование с образованием аланина.
С помощью иммобилизованных клеток Serratia marcescensиз треонина и глюкозы синтезируют L-изолейцин, а с помощью иммобилизованных клеток Corynebacterium glutamicum - L-глутаминовую кислоту из L-глюкозы; L-триптофан - из индола; L-орнитин - из L-аргинина.
Таким образом расширение производства аминокислот стало возможным благодаря изменению технологии получения промышленных биокатализаторов и снижению затрат при их производстве.
6. Получение органических кислот.Органические кислоты и их соли широко используются в пищевой, фармацевтической, текстильной, кожевенной, химической, металлургической и других отраслях промышленности, поэтому их получение является важным направлением крупнотоннажного микробиологического синтеза. Многие кислоты можно производить как химическим, так и микробиологическим путем, причем первый путь более предпочтителен, когда кислоты предполагается использовать для технических нужд, второй путь - для целей пищевой промышленности и медицины.
Источником углерода для микроорганизмов-продуцентов органических кислот являются углеводы, органические кислоты, спирты, алканы. Кислоты часто секретируются клетками, когда рост культуры в силу определенных причин тормозится и переходит в стационарную фазу.
Фактором, вызывающим прекращение роста микробных культур, может быть недостаток минеральных компонентов или витаминов. В случае получения органических кислот рост культур лимитируют источником азота, используя при этом избыточное количество источника углерода (и энергии). Интенсивный синтез кислот в стационарной фазе роста после исчерпывания дефицитного компонента продолжается до тех пор, пока в среде присутствует источник углерода и пока клетки продуцента жизнеспособны. Это в принципе позволяет надеяться на широкое применение иммобилизованных клеточных препаратов для получения органических кислот.
Хотя свойство продуцировать ту или иную органическую кислоту широко распространено среди микроорганизмов, на практике для получения кислот используют специально отобранные или мутантные высокопродуктивные штаммы, не синтезирующие побочных продуктов. В этих случаях выходы органических кислот - по существу, монопродуктов процесса - являются высокими: для молочной кислоты 90, глюконовой - 90-95, уксусной - 90-98, лимонной - 85%.
В настоящее время семь органических кислот производятся в промышленных масштабах, причем лимонную, глюконовую, кетоглюконовую, итаконовую и яблочную кислоты получают только микробиологическим путем, а молочную и уксусную - химическим и микробиологическим методами.
Важнейшей для промышленности органической кислотой является уксусная. Она используется при производстве волокон, фармацевтических препаратов, инсектицидов, в пищевой промышленности, как субстрат для получения аминокислот. Микробиологический способ экономически оправдан в случае получения пищевого уксуса (окисление этанола ацетобактериями). Производство столового уксуса (10%-ная кислота) составляет в мире 8-10 млн. м3в год. Техническую уксусную кислоту получают химическим синтезом (карбонили-рование метанола).
В зависимости от способа иммобилизации (адсорбция на буковых стружках, TiO2, ZrO2, керамике, хлопке, ионообменных смолах, включение в гели каррагинана, коллагена) продуктивность процесса варьирует в пределах 60 раз, концентрация уксусной кислоты изменяется от 20 до 110 г/л, операционная стабильность иммобилизованного биокатализатора достигает 270 сут. Иммобилизованные на древесной стружке ацетобактерии применяются в промышленности; ряд биокатализаторов, полученных на основе использования других способов иммобилизации, успешно испытан в установках и реакторах пилотного масштаба.
Молочная кислота - первая из органических кислот, которую начали производить путем брожения, в конце XIX века было налажено промышленное производство молочной кислоты при участии молочнокислых бактерий (Lactobacillus debrueckii, L.Leichmanii и L.bulgaricus). Молочную кислоту используют в качестве добавки к пищевым продуктам, сокам, эссенциям и напиткам, как окислитель в пищевой промышленности, в гальваностегии, а также при производстве пластмасс, когда L(+)форму кислоты полимеризуют в полилактат. Следует отметить, что практически вся производимая в США молочная кислота синтезируется химическим путем, в Европе половину ее получают при сбраживании глюкозы L.delbrueckii. Для интенсификации процессов получения молочной кислоты проводят исследования по применению иммобилизованных молочнокислых бактерий, а также по оптимизации конструкции биореакторов.
Молочнокислые бактерии были иммобилизованы путем включения в различные гели. Для получения молочной кислоты предложено использовать мембранный реактор, колонный реактор с полыми волокнами, колонный реактор с иммобилизованными включением в Са-альгинатный гель бактериями, соединенный с электродиализной ячейкой. Имеющиеся данные позволяют рассчитывать на 50-100-кратное увеличение производительности процесса. Время полужизни иммобилизованного Са-альгенатбиокатализатора на основе L.delbrueckii составляет 100 сут.
Лимонную кислоту получают из мелассы с помощью микроскопических грибов Aspergillus niger. В 2000 г. ее мировое производство составило 175 000 т. Лимонная кислота применяется как ароматизирующее средство и консервант пищевых продуктов, для очистки и шлифовки металлов (хелатирующий агент), в качестве пластификатора лакокрасочных материалов. Эфиры лимонной кислоты применяются при производстве пластмасс. В лабораторных условиях иммобилизация А.niger проводилась в гелях Са-альгената, каррагинана, агара, полиакриламида, путем адсорбции на полипропиленовых пленках и пластинках , включением в поперечно-сшитую глутаровым альдегидом коллагеновую мембрану. Применение иммобилизованных клеток приводит к увеличению скорости образования лимонной кислоты в несколько раз, операционная стабильность иммобилизованного биокатализатора достигает 30 сут.
Лимонную и изолимонную кислоты получают с помощью дрожжей Candida sp. Изолимонная кислота синтезируется и при использовании Penicillium janthinellum (некоторые виды Penicillium синтезируют диастереомер лимонной кислоты - аллозо-Ls -изолимонную кислоту). В лабораторных условиях осущест-влена иммобилизация указанных микроорганизмов в Са-альгинат и ПААГ.
Хорошие результаты по технологическому применению иммобилизованных клеток продемонстрированы при получении яблочной кислоты путем микробиологической трансформации фумаровой кислоты. С 1974 г. японская фирма “Танабо Сеяку” приступила к промышленному выпуску яблочной кислоты с использованием включенных в ПААГ мертвых клеток Brevibacterium ammoniagenes. В 1978 г. ПААГ был заменен на каррагинан, что позволило в 2,3 раза увеличить эффективность биокатализатора, а замена В.ammoniagenes на В.flavum еще в 2 раза увеличила его эффективность. В итоге появилась возможность с помощью однократно приготовленной партии иммобилизованного биокатализатора получить до 100 т яблочной кислоты (в настоящий момент производится 180 т). Продолжительность функционирования иммобилизованных в полиакриламидный гель клеток составляет около 60 суток, в геле на основе каррагинана – до 160 суток против 6 суток для свободных клеток. Конверсия фумарата (1М) - до 70%, время одного трансформационного цикла - около 5 ч.
Глюконовая кислота и ее лактон являются продуктами окисления глюкозы. Промышленное производство глюконовой кислоты с помощью А.niger было налажено еще в начале 20-х годов. Выход процессов ферментации (свободные клетки) с получением глюконовой кислоты равен 95%, концентрация глюкозы - 150-200 г/л.
Глюконовая кислота находит применение как моющее средство, ее соли используются в медицине, а лактон - как подкислитель в пищевой промышленности. Производные глюконовой кислоты - 2-кетоглюконовую и 5-кетоглюконовую кислоты - получают с помощью микроорганизмов Pseudomonas sp., Gluconobacter sp., Acetobacter sp., причем процесс получения 2-кетоглюконовой кислоты на основе свободных клеток нашел промышленное применение. Из 5-кетоглюконовой кислоты в результате химической гидрогенизации образуется L-идоновая кислота, а из нее осуществляется ферментативный синтез 2-кетогулоновой кислоты, являющейся полупродуктом для производства аскорбиновой кислоты.
Иммобилизацию микроорганизмов-продуцентов глюконовой и 2-кетоглюконовой кислот проводят с помощью адсорбционных методов (при использовании в качестве адсорбентов нейлонового волокна, керамики, анионообменника амберлита), а также включением в гели каррагинана, Са-альгината, коллагена, ПААГ.
Наиболее эффективны биокатализаторы, полученные методами включения в упругие гели ПААГ или Са-альгината, при их использовании были реализованы процессы превращения глюкозы, концентрацией до 200 г/л с продуктивностью до 10 г/л×ч (по глюконовой кислоте), продолжительность функционирования иммобилизованных клеток достигала 200 сут.
Итаконовую кислоту, применяющуюся при производстве пластмасс и красителей, получают с высоким выходом из глюкозы с помощью грибов А.terreus (процесс на основе свободных клеток внедрен в промышленную практику в СССР). На лабораторном уровне проводилась иммобилизация А.terreus в ПААГ, а также путем адсорбции на сетчатых дисках из пористой нержавеющей стали. В последнем случае использовался дисковый реактор: концентрация итаконовой кислоты достигала 20 г/л, реактор функционировал без изменения продуктивности, которая составляла до 1 г/л.ч, до 30 сут.
7. Получение антибиотиков. Применение биокатализаторов на основе иммобилизованных клеток позволило достичь больших успехов в области получения антибиотиков. Как важна область биотехнологии, связанная с синтезом антибиотиков, наглядно видно из стоимости мирового сбыта их четырех наиболее распространенных групп ( пенициллинов, цефалоспоринов, тетрациклинов и эритромицинов ( имеется в виду продажа для медицины и ветеринарии): в 1978 г она составляла свыше 4 млрд. дол., в 1980 г. - около 7 млрд. дол., в 1985 г. - около 8 млрд. дол. ( объем производства превысил 60 тыс. т в год), в 2000 г. более 20 млрд. дол.
Важность и масштабы производства антибиотиков обусловлены их применением в медицине и ветеринарии как противомикробных и противоопухолевых препаратов. С их помощью контролируется рост растений и ведется борьба с болезнями.
Новые поколения синтетических антибиотиков представляют собой сложные по химическому строению вещества, поэтому методы получения на основе полного химического синтеза не могут конкурировать с методами, в которых используются микроорганизмы. Шесть родов филаментозных грибов синтезируют около тысячи различных антибиотиков, в том числе цефалоспорины и пенициллины. Два рода нефиламентозных бактерий синтезируют 500 видов антибиотиков, а три рода актиномицетов - около 3 000 видов. Число известных антибиотиков увеличивается на несколько сотен каждый год.
Начиная с середины 60-х годов исследователи перешли от поиска новых антибиотиков к модификации структуры уже имеющихся. Особенно это было характерно для пенициллинов и цефалоспоринов, структура которых включает b-лактамное кольцо. Химическая модификация b-лактамного кольца ("добавление" к нему какой-либо химической группы) позволяет получить новые виды антибиотиков; их называют полусинтетическими.
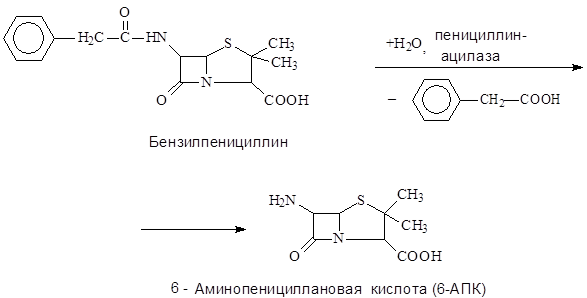
Ключевым полупродуктом для получения полусинтетических антибиотиков пенициллинового ряда является 6-аминопенициллановая кислота (6-АПК)
Получение 6-АПК в промышленности путем химического гидролиза бензилпенициллина сопряжено с большими трудностями в связи с крайней неустойчивостью лактамного цикла его молекулы. Так, при щелочном гидролизе бензилпенициллина выход 6-АПК составляет всего 1 %. Продуктивность этого процесса удалось значительно повысить благодаря применению для гидролиза иммобилизованных бактериальных клеток, содержащих пенициллинацилазу.
Со второй половины 70-х годов XX в. вся 6-АПК, выпускаема в СССР, и значительная часть 6-АПК, получаемая в Италии производились с помощью иммобилизованных ферментов.
На итальянских фирмах применяют фермент, иммобилизованный путем включения клеток Е. coli в волокна триацетата целлюлозы, на российских предприятиях используют бактериальные клетки, иммобилизованные в полиакриламидном геле. Переход к технологии, применяющей иммобилизованные бактериальные клетки обеспечивает высокий выход 6-АПК, составляющий 80-85%. По данным японских исследователей, время полуинактивации пенициллинацилазы, содержащейся в иммобилизованных в полиакриламидном геле бактериальных клетках, равно 42 суткам при 30°С или 17 суткам при 400С.
Внедрение в промышленность биокаталитической технологии производства 6-АПК привело к существенному увеличению выпуска полусинтетических пенициллинов и снижению их себестоимости.
Для получения промышленных биокатализаторов с целью трансформации антибиотиков используют иммобилизацию клеток микроорганизмов путем включения в ПААГ, сшитый глутаровым альдегидом желатиновый гель, связывание с глицидилметакрилатом с помощью глутарового альдегида. По существу при трансформации антибиотиков из всего многообразия ферментов клетки используется лишь один из них. Сохранять жизнеспособность клеткам при этом не обязательно, активность катализатора можно увеличивать за счет разрушения клеточных оболочек, служащих диффузионными барьерами на пути субстрата к ферменту.
Тем не менее, простота требований, предъявляемых к системе, когда при иммобилизации нет необходимости сохранять жизнеспособность клеток, является кажущейся. В частности, простое включение в гель клеток E.coli приводит к быстрой инактивации биокатализатора вследствие вымывания фермента в процессе получения геля. В связи с этим был разработан способ включения в ПААГ клеток, предварительно модифицированных в растворе мономеров путем сшивки бифункциональным реагентом.
При включении клеток E.coli в гели альгината по стандартной методике их содержимое конкурирует с полимером за связывание с ионами кальция. Результатом является лизис клеток, нарушение интактности клеточных структур. Стабильность такого биокатализатора иллюстрируют катализаторы фирмы “Спофа”, полученные на основе разрушенных клеток E.coli.
Резкого повышения стабильности удается достичь после "фиксирующей" модификации поверхности клеток до их контакта с раствором, содержащим ионы кальция. Эта фиксация резко меняет картину ультраструктуры иммобилизованных клеток, их удается сохранить структурно неизмененными.
Мягкое воздействие на клетки E.coli органическими растворителями, замещающими часть воды в клетке, приводит к изменению проницаемости клеточной стенки, увеличению доступа субстрата к внутриклеточным ферментам и ускорению вывода продукта при одновременном сохранении целостности покровов клетки, и, как следствие, активность биокатализатора и его стабильность существенно возрастают. Воздействие на клетки в процессе выращивания (температурный фактор, химические агенты) также позволяет получить микроорганизмы с повышенной проницаемостью клеточных оболочек. Активность и стабильность иммобилизованного биокатализатора на основе таких клеток возрастает.
Для иммобилизации микроорганизмов, осуществляющих биосинтез антибиотиков, применяют разные методы - включение в ПААГ, гели Са-альгината, каррагинана, агара, коллагена, включение в полые волокна, адсорбция на цеолите, пенополиуретане, поликарбонате, нейлоне, полисульфоне, стали. Биосинтез антибиотиков с помощью иммобилизованных клеток не имеет пока промышленного значения, но исследования в этом направлении интенсивно развиваются.
8. Трансформация стероидов. Одна из первых работ, посвященных иммобилизованным клеткам, касалась трансформации стероидов (в ней шла речь о гидроксилировании стероида кортексолона). В настоящее время все основные энзиматические процессы, используемые в стероидной химии, осуществлены с помощью иммобилизованных клеток: 1.2-дегидрирование, 11-a- и 11-b-гидрокси-лирование, стереоспецифическое 17-b-восстановление, 20-a- и 20-b-восстановление, дезацетилированние, трансформация стеринов и некоторые другие. Острая необходимость применения для трансформации иммобилизованных клеток обусловлена тем, что стереотрансформирующие ферменты, особенно гидролазы и гидрогеназы, являются весьма лабильными, их выделение и очистка затруднены. Иммобилизованные клетки могут служить в этих случаях "носителем" активных и стабильных полиферментных систем, регенерирующих необходимые им кофакторы.
Промышленный синтез многих лекарственных препаратов на основе стероидов стал возможен с развитием методов микробиологической трансформации. В качестве сырья для промышленных процессов используют природные стерины, выделяемые из растений или различных органов животных.
Трансформацию стероидов осуществляют с помощью различных микроорганизмов, для иммобилизации которых предложен широкий круг методов.
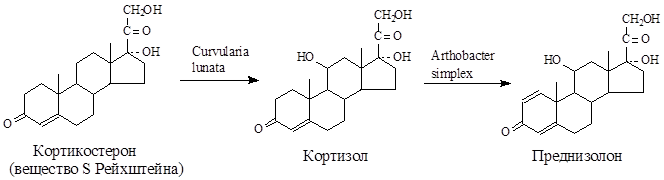
Максимальная стабильность и активность в непрерывном (проточном) реакторе наблюдается у клеток, адсорбированном на керамическом носителе, в условиях периодического реактора - у клеток, включенных в ПААГ. В случае иммобилизации в ПААГ период полуинактивации составил 5 мес. (160 циклов трансформации) при сохранении 95%-ного превращения гидрокортизона в преднизолон. Практически во всех носителях (кроме каррагинана) дегидрогеназная активность сохраняется на уровне активности свободных клеток, причем клетки в иммобилизованном состоянии остаются жизнеспособны.
Трансформация стероидов является одним из примеров реализованных в промышленности процессов, основанных на использовании иммобилизованных клеток.
В настоящее время интенсивно разрабатываются методы использования нерастворимых микрокристаллических стероидных субстратов для иммобилизованных клеток. В этих случаях применяют диспергирование и измельчение субстрата, а также превращение его в водорастворимое состояние (с помощью циклодекстринов). Предложен также новый метод проведения реакций, как для свободных, так и для иммобилизованных клеток и в двухфазных водно-органических системах. Клетки при этом локализованы в водной фазе (внутри гранул носителя) и мало подвержены воздействию органического растворителя, не смешивающегося с водой.
В качестве катализатора реакции дегидрирования стероидов в среде бензола и гептана используются различные виды бактерий Nocargia sp., иммобилизованные в гидрофобном носителе. Бактерии, включенные в гидрофобные гели (уретановые полимеры), обладают большей активностью и стабильностью, чем находящиеся в гидрофильном окружении, что определяется характером распределения субстрата между гелем и окружающим растворителем.
Наконец, следует отметить еще одну возможность утилизации нерастворимого стероидного субстрата, когда клетки и частицы субстрата одновременно включают в гранулы геля (альгината, агара, агарозы). После осуществления цикла трансформаций гранулы геля разрушают, клетки удаляют центрифугированием и рециклизуют, а продукт (преднизолон) экстрагируют из супернатанта органическими растворителями.
9. Получение ферментов. С точки зрения применения иммобили-зованных клеток речь может идти в первую очередь о получении внеклеточных ферментов (производст
Дата добавления: 2020-10-01; просмотров: 649;











