Анализ состава популяции клеток
Методы анализа популяций клеток можно классифицировать примерно таким же образом, как и математические модели, описывающие кинетику роста культур клеток. Большинство классических методов биохимии дает усредненную по всей популяции и, следовательно, несегретированную информацию. Такие методы можно распространить на очень большое число компонентов клетки вплоть до отдельных белков, молекул РНК и ДНК и даже последовательностей их фрагментов. Если же экспериментальные данные относятся к одной клетке или могут дать информацию о состоянии отдельных клеток, так что в конечном счете удается получить сведения о распределении свойств отдельных клеток, то такие данные можно назвать сегрегированными. Прежде всего, мы обсудим методы, дающие информацию несегрегированного типа. К наиболее грубым результатам таких методов после данных по определению массовой или численной плотности популяции относятся данные об элементном составе клеток, включая содержание углерода, водорода и азота. Разработаны автоматические анализаторы, предназначенные, например, для определения общего азота в пробах. Известно, что в биологических процессах важную роль играет ряд ионов, поэтому в анализах на элементы обычно определяют также общее содержание железа, магния, фосфора и кальция. Общее содержание белков, РНК, ДНК и других компонентов клеток большой молекулярной массы определяют с помощью хорошо известных методов. В качестве примера на рис. 9 перечислены основные операции методики определения макромолекулярных компонентов дрожжей.
Здесь мы не имеем возможности детально описывать каждый из методов анализа различных макромолекулярных соединений; подробные сведения можно найти в работах [14, 15], а также в многочисленных статьях, посвященных определению состава клеток в процессе их роста. Хотя любую конкретную методику определения какого-либо вещества, например белка или ДНК, можно применять для анализа различных организмов, в зависимости от вида последних может потребоваться та или иная модификация этой аналитической методики.
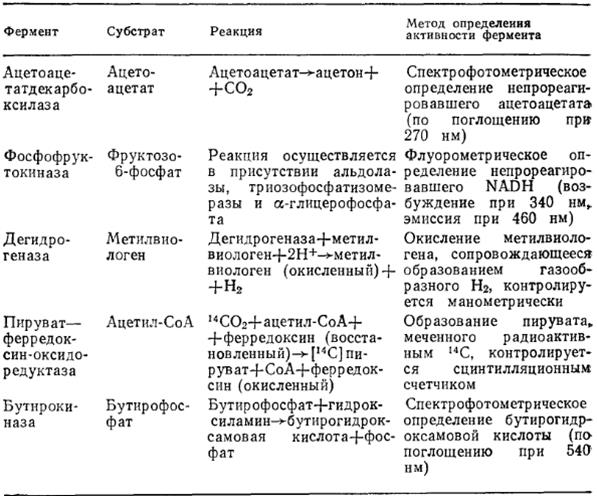
Усредненное содержание конкретных белков в популяции клеток можно определять несколькими методами. Что касается ферментов, то для контроля за изменением их концентрации в ходе процесса обычно измеряют соответствующую ферментативную активность. В табл. 3 перечислены характерные реакции и принципы измерений, используемые для определения концентраций основных ферментов, участвующих в метаболическом превращении глюкозы в органические растворители в  микробиологическом процессе производства ацетона и бутанола с помощью Clostridium acetobutylicum.
микробиологическом процессе производства ацетона и бутанола с помощью Clostridium acetobutylicum.
РИС, 9. Операционная карта методики определения концентраций (усредненных по популяции) белка и РНК в дрожжевых клетках. Подробное описание методики Лоури и орсинового метода приведено в работах [14, 15].
Таблица 3. Типичные субстраты и методы определения активности основных ферментов, участвующих в путях катаболизма в Clostridium acetobutylicum
На рис. 10 представлены зависимости активности ряда основных ферментов этого организма от времени периодического процесса. Как показывают эти данные, на последних фазах процесса активности ферментов, участвующих в биосинтезе кислот, снижаются, а активности ферментов, связанных с образованием бутанола и ацетона, напротив, возрастают. Подобная информация может быть полезной при выяснении зависимостей между изменением клеточного метаболизма, природой штамма микроорганизма и эксплуатационными параметрами биореактора; эти данные в свою очередь необходимы для оптимизации как организма, так и процесса.
 РИС. 10. Рост Clostridium acetobutylicum в периодическом процессе и изменение концентраций ферментов, участвующих в образовании продуктов метаболизма.
РИС. 10. Рост Clostridium acetobutylicum в периодическом процессе и изменение концентраций ферментов, участвующих в образовании продуктов метаболизма.
а — параметры клеточного роста и образования продуктов метаболизма: 1 — оптическая плотность; 2 — значение рН; 3 — концентрация ацетата; 4 — концентрация бутирата; 5 — концентрация ацетона; 6 — концентрация бутанола.
б — концентрации ферментов, участвующих в биосинтезе ацетата и бутирата, а также гидрогеназы: 1 — фосфотрансацетилаза; 2—ацетаткиназа; 3 — фосфотрансбутирилаза; 4 — бутираткиназа; 5 — гидрогеназа.
в — концентрации ферментов, участвующих в образовании ацетона и бутанола: 1 или 2 — ацетоацетил-СоА: СоА — трансфераза с ацетатом или бутиратом в качестве акцептора соответственно; 3 — ацетоацетатдекарбоксплаза; 4 — бутиральдегиддегидрогеназа; 5 — бутанолдегидрогеназа. [Воспропзведено с разрешения из статьи: Andersch W., Bahl Н.. Gottschalk G., Level of Enzvmes Involved in Acetate, Butyrate, Acetone and Butanol Formation by Clostridium acetobutylicum, Eur. J. Appl. Microbiol. Biotechnol., 18, 327 (1983).]
Индивидуальные белки иногда можно определять хроматографическими или электрофоретическим методами путем измерения интенсивностей отдельных полос. Для того чтобы повысить разрешающую способность и чувствительность электрофоретического метода при самых разных концентрациях белков, можно применять двумерный электрофорез в геле; в этой методике белки разделяют в одном направлении по величине их молекул, а во втором направлении — по заряду. При таком разделении индивидуальные белки концентрируются в виде пятен на плоскости, что позволяет идентифицировать и количественно определять большое число белков одновременно. Эта методика применялась, например, для изучения скоростей синтеза 140 различных белков в процессе роста бактерии Е. colі [17].
Основой другого метода анализа индивидуальных белков является связывание антител с определенным участком молекулы изучаемого белка [18]. Если в распоряжении исследователя имеются антитела, специфичные по отношению к изучаемому белку, то последний можно определить количественно путем осаждения комплекса белок — антитело или посредством детектирования антител, меченных радиоактивными изотопами, или путем измерения активности фермента, связываемого с изучаемым белком (метод иммуносорбционного ферментативного анализа, ELISA). Аналогично можно определять и другие компоненты системы, в том числе и высокомолекулярные соединения, если только удается найти антитела, специфичные в отношении этих компонентов. Меченые антитела часто применяют для идентификации на поверхности клеток определенных соединений или структур, а в некоторых случаях таким путем удается определить и количество этих соединений на наружной поверхности клеток. Связывание антител с теми или иными соединениями на поверхности клеток и последующие измерения могут быть выполнены и без потери жизнеспособности организмов, что особенно важно при скрининге и селекции мутантных штаммов. Этот метод пригоден и для обнаружения определенных штаммов в смешанных культурах, поскольку каждый организм обычно имеет на своей поверхности специфические соединения-маркеры, которые с помощью соответствующих антител можно селективно идентифицировать и определять количественно.
Важность плазмид как носителей генетической информации, используемой для синтеза необходимых веществ в рекомбинантных организмах, обусловливает потенциальную ценность методов определения содержания плазмид в клетках. Наиболее надежный метод количественного определения плазмид в бактериях заключается в выделении суммарной ДНК организма с последующим разделением плазмидной и хромосомальной ДНК ультрацентрифугированием в градиенте хлорида цезия. Относительные количества хромосомальной и плазмидной ДНК можно определять несколькими методами. При использовании меченных радиоактивными изотопами препаратов ДНК можно, например, отделить осадок после центрифугирования и определить его радиоактивность с помощью сцинтилляцнонного счетчика. Содержание плазмидной ДНК в клетках дрожжей или животных клетках можно оценить методом гибридизации с помощью меченого зонда, комплементарного специфической нуклеотидной последовательности плазмиды. Другой подход к определению содержания плазмид в организмах основан на включении в плазмиду в качестве маркера гена какого-либо конкретного фермента, активность которого можно было бы затем легко определить. Такой подход применялся для оценки количества плазмид в рекомбинантных клетках бактерий, дрожжей и животных организмов.
Все рассмотренные выше методы анализа дают информацию о составе клеток и в некоторой степени о характере их метаболизма, но не сообщают непосредственно никаких данных об энергетическом состоянии организма в данный момент. Количество внутриклеточного АТР можно определить с помощью анализатора типа Биометр. Этот прибор измеряет интенсивность люминесценции, генерируемой в реакции с участием АТР, которая катализируется ферментом люциферазой. Поскольку концентрация АТР может очень быстро изменяться в зависимости от окружения клетки и ее метаболической активности, необходимо до анализа этим (или иным) методом быстро обработать образцы популяции клеток фосфорной кислотой; в противном случае нельзя гарантировать сохранение концентрации АТР в процессе анализа. Так как в нежизнеспособных клетках АТР отсутствует, то путем определения содержания АТР иногда можно оценить и долю метаболически активной биомассы в популяции.
Для определения внутриклеточных концентраций АТР, ADP, фосфатов сахаров, полифосфата и величины рН успешно применялась спектроскопия ядерного магнитного резонанса (ЯМР) ка ядрах 31Р. Этим методом изучали различные микроорганизмы, в том числе бактерии Е. coli [19] и Clostridium thermocellum [20], дрожжи Saccharomyces cerevisiae, Candida utilis и Zygosaccharomyces bailii [21]. Для изучения путей внутриклеточного метаболизма углерода и азота можно применять также спектроскопию ЯМР 13С и 15N, если изучаемый организм выращен на субстратах, обогащенных изотопами 13С и (или) 15N [23, 24].
В некоторых процессах с участием мицелиальных микроорганизмов наблюдалась зависимость эффективности и кинетики этого процесса от морфологического состояния плесени или актиномицета. В примере 7.2 мы уже обсуждали некоторые данные о связи между морфологией и образованием антибиотика цефалоспорина в культуре плесени Cephalosporium acremoтит. Непосредственное качественное визуальное изучение и количественный контроль морфологии мицелия очень сложны и трудоемки, поскольку они связаны с большим объемом работ по микроскопии и с ручным или автоматическим анализом полученных данных. Морфология мицелия, как было показано, влияет на его поведение при фильтровании. Ванг и сотрудники [25, 26] использовали эту зависимость для создания остроумного метода определения морфологии мицелия на основе данных по изучению фильтрования пробы культуры, который далее был усовершенствован Лимом и сотрудниками [27]. В этом методе периодически отбирают небольшую пробу культуральной суспензии, фильтруют ее и затем определяют объем фильтрата и толщину слоя осадка на фильтре. Полученные таким путем данные в совокупности с найденными ранее корреляциями между параметрами процесса фильтрования и морфологическими свойствами и плотностью изучаемой культуры плесени могут служить основой для периодического непосредственного контроля за ходом ферментации.
Существует несколько методов изучения и определения распределения характеристик индивидуальных клеток в популяции одноклеточных организмов. Такие распределения приближенно можно оценить методом микроскопии, а в сочетании с методами анализа изображений можно получить и информацию количественного характера, хотя сбор характеристик достаточно большого числа клеток, необходимых для получения статистически достоверной информации, очень трудоемок. Для быстрого определения свойств большого числа индивидуальных клеток более удобны непрерывные методы измерения в потоке. Имеются два основных типа таких методов. В приборах типа счетчика Коултера объем отдельных клеток определяют путем измерения сопротивления небольшого отверстия, через которое протекает изучаемая проба (суспензия клеток), разбавленная раствором электролита. Известна зависимость между объемом сферической частицы и изменением удельного сопротивления отверстия; таким путем можно определить размеры большого числа быстро протекающих через отверстие суспендированных частиц. Некоторые затруднения при интерпретации результатов измерений может вызвать изменение морфологии клеток; тем не менее этот метод позволяет получить ценную информацию о распределении клеток популяции по размерам.
 Более универсальны приборы, называемые проточными цитометрами. В этих приборах разбавленная суспензия клеток также проходит через детектирующее устройство, однако здесь измеряются оптические свойства суспензии. Как показано на схеме прибора (рис. 11), в проточном цитометре поток пробы облучают с помощью лазера или другого источника света, а затем измеряют поглощение, рассеяние и (или) флуоресценцию индивидуальных клеток. Результаты изучения рассеяния света можно использовать для получения информации о распределении клеток по размерам.
Более универсальны приборы, называемые проточными цитометрами. В этих приборах разбавленная суспензия клеток также проходит через детектирующее устройство, однако здесь измеряются оптические свойства суспензии. Как показано на схеме прибора (рис. 11), в проточном цитометре поток пробы облучают с помощью лазера или другого источника света, а затем измеряют поглощение, рассеяние и (или) флуоресценцию индивидуальных клеток. Результаты изучения рассеяния света можно использовать для получения информации о распределении клеток по размерам.
РИС. 11. Схема проточного цитометра. На схеме показаны пути потока суспензии клеток и лазерных лучей, оптические фильтры, детекторы для определения параметров индивидуальных клеток, а также способы генерации, анализа и хранения информации. Размещенными по диагонали квадратами изображены дихроичные светофильтры (отражающие излучение определенных длин волн и пропускающие излучение другой длины волны); расположенными под прямым углом квадратами обозначены задерживающие или поляризационные светофильтры. В таких приборах часто устанавливают несколько детекторов типа фотоумножителей н соответствующих электронных устройств, что позволяет одновременно определять несколько параметров каждой клетки. (За основу взят прибор Ortho Instruments Cytofluorograph System 50H.)
Поскольку интенсивность рассеяния света под прямым углом зависит от наличия и концентрации специфических внутриклеточных структур, этот метод успешно применялся для контроля накопления в индивидуальных бактериальных клетках частиц резервного углевода, полигидроксибутирата, обладающих характерным показателем преломления [28]. С помощью специфических флуоресцентных красителей, выполняющих роль метки, в клетках микроорганизмов и животных клетках определяли распределение концентраций различных биополимеров, в том числе суммарного клеточного белка, двухцепочечной ДНК и клеточной РНК [29, 30]. С помощью проточных цитометров можно также следить за накоплением в отдельных клетках внутриклеточного флуоресцирующего соединения, образующегося при действии конкретного фермента. Таким путем можно устанавливать активность одного фермента в индивидуальных клетках, изучать in vitro кинетику ферментативных реакций, определять (путем клонирования гена, отвечающего данному ферменту) содержание плазмид в клетке [31]. Методом цитометрии в потоке, кроме того, можно идентифицировать и определять содержание конкретных штаммов в смешанных культурах и обнаруживать посторонние штаммы в посевном материале [32, 33]. Поскольку метод цитометрии в потоке дает информацию не только об усредненных параметрах популяции, но и о распределении характеристик индивидуальных клеток, это позволяет получить более детальные данные о состоянии популяции микроорганизмов.
Хотя в большинстве случаев методом цитометрии в потоке измеряли лишь один параметр микробиологического процесса, при помощи этого метода можно определять и несколько параметров индивидуальных клеток одновременно, что позволяет получать еще более детальную информацию о состоянии популяции клеток. При одновременном определении двух параметров результаты измерений изображают на плоскости в виде зависимости частоты или относительного числа клеток от двух изучаемых параметров, величины которых откладывают на осях координат, ограничивающих указанную плоскость. В качестве примера на рис. 12 приведены результаты одновременного определения интенсивности рассеяния света (связанной с размером клеток) и внутриклеточной флуоресценции, эмиссия которой происходит с участием фермента, кодируемого плазмидным геном. Таким способом можно найти корреляцию между количеством флуоресцирующих веществ, накопленных клеткой, и наличием или даже числом плазмид в одной дрожжевой клетке. На рис. 12 видны два четких пика, отвечающие клеткам разных типов в изучаемой культуре. Клетки с низкой интенсивностью флуоресценции не содержат плазмид, поскольку в условиях этого эксперимента для нативных клеток типичен низкий уровень естественной флуоресценции. Часть популяции клеток с более интенсивной флуоресценцией, зарегистрированных в виде второго четкого пика, содержит плазмиды, а следовательно, и фермент, ответственный за повыщение интенсивности флуоресценции. Этот метод позволяет быстро оценить относительное содержание клеток с плазмидами и без плазмид в культуре и таким образом получить ценную информацию о репликации плазмид и процессах расщепления рекомбинантного штамма.

РИС. 12. Изучение популяции рекомбинантных клеток Saccharomyces cerevisiae путем определения двух параметров методом цитометрии в потоке. На осях координат базисной плоскости отложены интенсивность рассеяния света индивидуальными клетками (связанная с размером клеток) и интенсивность флуоресценции индивидуальных клеток (в данном случае связанная с числом плазмид в одной клетке). Флуорометрия позволяет легко различать клетки с плазмидами и клетки, не содержащие плазмид.
ЭВМ и интерфейсы
Сочетание контрольно-измерительной аппаратуры с цифровыми ЭВМ выгодно в нескольких отношениях. Во-первых, ЭВМ может разносторонне усовершенствовать работу по сбору данных. Статистические методы н методы цифрового фильтрования позволяют повысить надежность и точность результатов измерений. ЭВМ могут сравнивать отклики нескольких параллельных детекторов и анализировать результаты сравнения; в частности, таким путем в ходе измерений можно проверять правильность калибровки детекторов и находить детекторы, вышедшие из строя. ЭВМ позволяют увеличить число аналитических приборов и использовать более сложные аналитические методы. Например, управляемая ЭВМ аналитическая система может автоматически отбирать пробы, проводить хроматографический анализ, интерпретировать результаты анализа с помощью хранящихся в ее памяти градуировочных шкал или алгоритмов и выдавать выходной сигнал в удобной для оператора форме. Хотя простейшие операции согласования и коррекции сигналов (например, линеаризация) можно выполнять также с помощью специальных электронных схем, ЭВМ позволяют осуществить эти операции без всяких дополнительных приборов. Другое преимущество ЭВМ при сборе данных связано с их способностью хранить в памяти большое число результатов измерений в цифровой форме. При необходимости эти данные можно вызывать из памяти машины в любое удобное время, подвергать анализу и отображать в необходимом виде.
ЭВМ позволяют существенно улучшить качество анализа и интерпретации данных. С их помощью можно, например, по результатам нескольких измерений практически мгновенно вычислить такие важные параметры, как скорость утилизации кислорода и дыхательный коэффициент. Дополнительную информацию о ходе процесса можно получить по результатам ограниченного числа измерений с помощью современных неавтономных методов расчета состояния и параметров системы. Несколько детальнее проблема применения ЭВМ для анализа данных освещена в следующем разделе; там же приведен ряд конкретных примеров.
ЭВМ в очень большой степени расширяют возможности оптимизации процессов и управления ими. Одна ЭВМ, заменяя множество традиционных аналоговых регуляторов, может с помощью стандартных алгоритмов обратной связи одновременно регулировать несколько переменных, например рН и температуру. ЭВМ облегчают внедрение сложных методов регулирования, в которых учитывается несколько параметров одновременно, например регулирование определяемого расчетным путем дыхательного коэффициента. Их можно применять для оценки и совершенствования математических моделей процессов, которые затем в свою очередь могут быть использованы для нахождения оптимальных условий и режима процесса. Более того, блок памяти и расчетный блок ЭВМ обеспечивают выполнение, например, программы скорости подачи питательных веществ или изменения рН в периодическом микробиологическом процессе.
Управление периодическим процессом, по сути дела, заключается в тщательно контролируемом и координируемом последовательном включении, выключении и переключении насосов, вентилей и клапанов. Ранее все эти операции выполнялись различными таймерами и реле, а теперь с ними успешно справляются ЭВМ. Использование ЭВМ для управления операциями переключения целесообразно в тех случаях, когда возникает необходимость в регулировании нескольких параллельных периодических процессов (например, ферментеров), продукты которых далее последовательно поступают на ту или иную периодическую операцию обработки (например, осаждение, хроматографическое разделение и т, д.).
Прежде чем перейти к интереснейшей теме применения ЭВМ, вкратце ознакомимся с некоторыми принципами устройства цифровых компьютеров и соответствующих интерфейсов.
Здесь мы рассмотрим только самые общие принципы и понятия, а также ряд конкретных примеров сочетания ЭВМ с процессами.
Дата добавления: 2020-10-01; просмотров: 866;











