Окислительно-восстановительные ферменты
Клеточное дыхание.Дыхание и связанный с ним ферментативный распад углеводов — важнейший источник энергии, и многочисленных промежуточных продуктов, которые клетка использует в различных метаболистических процессах.
Различают аэробное дыхание, протекающее в присутствии кислорода, и анаэробное, не требующее кислорода (брожение).
Суммарное уравнение аэробного дыхания:
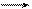 С6Н12О6 + 6О2 6СО2 + 6Н2О + 2870 кДж
С6Н12О6 + 6О2 6СО2 + 6Н2О + 2870 кДж
Гексоза
Анаэробное дыхание может протекать по трем основным типам:
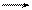 Спиртовое брожение:С6Н12О6 2С2Н5ОН + 234 кДж
Спиртовое брожение:С6Н12О6 2С2Н5ОН + 234 кДж
Гексоза Этанол
 Молочнокислое брожение:С6Н12О6 2СН3СНОНСООН
Молочнокислое брожение:С6Н12О6 2СН3СНОНСООН
Гексоза Молочная кислота
 Молочнокислое брожение:С6Н12О6 СН3СН2СН2СООН + 2СО2 + 2Н2
Молочнокислое брожение:С6Н12О6 СН3СН2СН2СООН + 2СО2 + 2Н2
Гексоза Масляная кислота
Приведенные реакции не отражают всей сложности многочисленных ферментативных реакций, осуществляемых комплексом ферментов, главным образом, оксидоредуктазами и лиазами.
Взаимосвязь двух типов дыхания обусловлена общим первым этапом, в процессе которого глюкоза ферментативным путем превращается в пировиноградную кислоту — СН3СОСООН (гликолиз), затем пути расходятся: в аэробных условиях пировиноградная кислота окисляется до уксусной кислоты, которая под действием кофермента А, переходит в активированную форму ацетил КоА, последняя включается в цикл Кребса, где полностью окисляется до СО2 и Н2О с выделением большого количества энергии. В анаэробных условиях пировиноградная кислота превращается в ацетоальдегид и СО2; ацетоальдегид, в свою очередь, может переходить в этанол (спиртовое брожение).
В качестве дыхательного материала в растениях кроме углеводов могут использоваться жиры (например, при прорастании семян масличных культур), белки и аминокислоты (например, при прорастании семян бобовых культур), органические кислоты (например, в листьях и побегах суккулентных растений).
В зависимости от преимущественного использования тех или иных веществ, в процессе дыхания изменяется величина дыхательного коэффициента[1]. При аэробном распаде гексоз дыхательный коэффициент равен 1, а при распаде яблочной кислоты (при аэробном дыхании в плодах) — 1,33.
Интенсивность дыхания зависит от температуры и влажности сырья. Снижение этих параметров уменьшает интенсивность дыхания и увеличивает срок хранения сырья.
Полифенолоксидаза (Н.Ф. 1.14.18.1). Этот фермент известен под различными тривиальными названиями: о-дифенолоксидаза, тирозиназа, фенолаза, катехолаза и др. Фермент может катализировать окисление моно-, ди-, и полифенолов.
Молекула фермента обладает четвертичной структурой и имеет молекулярную массу около 34000 Да. Полифенолоксидаза — купропротеид, содержит один атом Cu на молекулу фермента. Зона оптимальной активности лежит между рН 5,0–7,0. В зависимости от того из какого источника выделен фермент, способность его к окислению различных фенолов различна. Более того, даже в одном и том же объекте полифенолоксидаза может содержаться в виде различных молекулярных форм, отличающихся по способности к окислению различных фенолов.
С действием этого фермента связано образование темноокрашенных соединений — меланинов при окислении кислородом воздуха аминокислоты тирозина. Потемнение срезов картофеля, яблок, грибов, персиков и других растительных тканей в большей степени или полностью зависит от действия полифенолоксидазы. В пищевой промышленности основной интерес к этому ферменту сосредоточен на предотвращении, рассмотренного нами, ферментативного потемнения, которое имеет место при сушке плодов и овощей, а также при производстве макаронных изделий из муки с повышенной активностью полифенолоксидазы. Эта цель может быть достигнута путем тепловой инактивации фермента (бланшировка), добавлением ингибиторов (NaHSO3, SO2, NaCl) или связыванием субстрата посредством метилирования.
Положительная роль фермента проявляется при некоторых фермен-тативных процессах: например, при ферментации чая. Окисление дубильных веществ чая под действием полифенолоксидазы приводит к образованию темноокрашенных и ароматических соединений, которые определяют цвет и аромат черного чая.
Каталаза (Н.Ф. 1.11.1.6). Этот фермент катализирует разложение пероксида водорода на кислород и воду.
Каталаза относится к группе гемопротеиновых ферментов, содержит 4-е атома железа в виде геминовой группировки на одну молекулу фермента. Молекулярная масса ферментов, выделенных из различных объектов (дрожжей, растительных и животных тканей, микроорганизмов), лежит в пределах от 225000 до 250000 Да. Они имеют существенные различия в оптимуме рН (от 2 до 9), в термо- и рН-стабильности. Фермент ингибируется цианидом (обратимо), фенолами (обратимо лишь в слабой форме), щелочью и мочевиной (необратимо). Функцией каталазы в живом организме является защита клетки от губительного действия перекиси водорода.
Хорошим источником для получения промышленных препаратов каталазы являются культуры микроорганизмов и печень крупного рогатого скота. Каталаза находит свое применение в пищевой промышленности при удалении избытка Н2О2 при обработке молока в сыроделии, где последняя используется в качестве консерванта; а также совместно с глюкозооксидазой применяется для удаления кислорода и следов глюкозы.
Пероксидаза (Н.Ф. 1.11.1.7). Пероксидазы — ферменты, катализирующие реакции окисления различных веществ пероксидом водорода. Пероксидаза — двухкомпонентный фермент, представляющий собой сочетание гема и гликопротеида. Показано, что углеводная часть придает белку большую специфичность; предполагают, что углеводы стабилизируют трехмерную структуру фермента.
В настоящее время выделено и охарактеризовано большое число множественных форм фермента, и доказано существование изоферментов, т.е. тех форм ферментов, которые обусловлены генетически. В связи с этим, принято говорить о целой системе пероксидаз, работающей в любом живом организме. Интересным представляется факт широкой субстратной специфичности пероксидаз по отношению к донорам водорода (1-ый субстрат), ими могут служить фенолы, амины, другие органические соединения; и строгой специфичности по отношению к акцептору водорода (2-ой субстрат) — перекиси водорода.
Изучению пероксидазы были посвящены классические работы Г. Теореля, Б. Чанса, А. Н. Баха, Р. Шода. Наиболее активная пероксидаза выделена из корней хрена. Ее молекулярная масса равна примерно 40000 Да, изоэлектрическая точка 7,2. Фермент содержит один атом железа на молекулу. Он достаточно устойчив в растворах при величинах рН от 4 до 12; его термостабольность значительно выше термостабильности каталазы. Оптимум рН для пероксидазы хрена равен 7; при рН от 6 до 8 сохраняется 70% его активности.
Липоксигеназа (Н.Ф. 1.13.11.12). Этот фермент катализирует окисление полиненасыщенных высокомолекулярных жирных кислот (линолевой и линоленовой) кислородом воздуха с образованием гидроперекисей, обладающих сильными окислительными свойствами, и именно на этом основано использование липоксигеназы в пищевой промышленности.
Липоксигеназа впервые была выделена из семян сои в 1928 году. Последующие исследования показали, что липоксигеназа широко распространена и в других растительных объектах: пшенице и других злаках, в семенах масличных и бобовых культур, в картофеле, баклажанах и т.д.
Тем не менее, самым богатым источником фермента является мука соевых бобов. Липоксигеназа, полученная в кристаллическом состоянии из семян сои, имеет молекулярную массу 102000 Да, изоэлектрическую точку 5,4. Оптимумы рН для ферментов, выделенных из различных объектов, сильно различаются. Оптимум температуры липоксигеназы находится между 20 и 300С.
В зерне пшеницы активность липоксигеназы колеблется в значительных пределах и является сортовым признаком. Кроме того, активность липоксигеназы связана с показателем жизнеспособности зерна. Она закономерно снижается со снижением всхожести зерна и может быть биохимическим тестом жизнеспособности семян. Значительная часть липоксигеназы пшеницы прочно связана с клейковинными белками и освобождается при обработке клейковинного комплекса раствором восстановленного глютатиона.
Липоксигеназе принадлежит важная роль в процессах созревания пшеничной муки, связанных с улучшением ее хлебопекарных достоинств. Образующиеся под действием фермента продукты окисления жирных кислот способны вызывать сопряженное окисление ряда других компонентов муки (пигментов, SH-групп клейковинных белков, ферментов и др.). При этом происходит осветление муки, укрепление клейковины, снижение активности протеолитических ферментов и другие положительные изменения.
В разных странах разработаны и запатентованы способы улучшения качества хлеба, основанные на использовании препаратов липоксигеназы (главным образом, липоксигеназы соевой муки). Все они требуют очень точного дозирования фермента, так как даже небольшая передозировка приводит к резко отрицательному эффекту и вместо улучшения качества хлеба происходит его ухудшение.
Более мягкий способ воздействия на компоненты муки и теста связан с активацией собственной липоксигеназы муки путем некоторого варьирования технологическим процессом. При этом исключается эффект передозировки фермента со всем комплексом нежелательных последствий.
Использование липоксигеназы как улучшителя окислительного действия требует определенной осторожности, т.к. хорошо известна токсичность переокисленных жиров. Интенсивное окисление липоксигеназой свободных жирных кислот может сопровождаться вторичными процессами образования веществ различной химической природы с неприяным вкусом и запахом, характерным для прогорклого продукта. Технологически приемлема ограниченная степень окисления полиненасыщенных жирных кислот как промежуточного звена преобразования других компонентов биологического материала, не приводящая к накоплению фракции окисленных липидов.
Глюкозооксидаза (Н.Ф. 1.1.3.4).Этот фермент был впервые выделен еще в 1904 году Н. А. Максимовым из плесневых грибов. Фермент представляет собой флавопротеид, в котором белок соединен с двумя молекулами ФАД. Он окисляет глюкозу с образованием в конечном счете глюконовой кислоты и обладает практически абсолютной специфичностью по отношению к глюкозе. Высокоочищенные препараты глюкозооксидазы получают из плесневых грибов рода Аspergillus и Penicillium. Они имеют примерно одинаковый молекулярную массу около 150000 Да, изоэлектрическую точку 4,2–4,3 и оптимум рН 5,6.
В последние годы глюкозооксидаза получила широкое применение. Благодаря исключительной специфичности препараты глюкозооксидазы применяются как аналитическое средство для количественного определения глюкозы. Кроме этого, препараты глюкозооксидазы нашли применение в пищевой промышленности, как для удаления следов глюкозы, так и для удаления следов кислорода. Первое — необходимо при обработке пищевых продуктов, качество и аромат которых ухудшаются из-за того, что в них содержатся восстанавливающие сахара; например, при получении из яиц сухого яичного порошка. Здесь имеется в виду реакция Майяра, так как глюкоза при сушке и хранении яичного порошка, особенно при повышенной температуре, легко вступает в реакцию с аминными группами аминокислот и белков. Порошок темнеет и образуется ряд веществ с неприятным вкусом и запахом. Второе — необходимо при обработке продуктов, в которых длительное присутствие небольших количеств кислорода приводит к изменению аромата и цвета (пиво, вино, фруктовые соки, майонез). Внесение пакетиков, содержащих смесь воды, глюкозы, фермента и буфера, способствует удалению кислорода из воздушного пространства. Во всех подобных случаях в ферментную систему включают каталазу, разлагающую Н2О2, которая образуется при реакции глюкозы с кислородом. Этот метод нашел широкое применение для удаления кислорода из банок с сухим молочным порошком.
Дата добавления: 2020-10-01; просмотров: 688;











