Болезни с дефицитом компонентов комплемента
Разные компоненты комплемента кодируются разными аутосомными генами, локализованными в разных хромосомах. С MHC в хромосоме 6 сцеплены только гены C2, C4 и фактора В. Болезни дефицита компонентов комплемента встречаются редко, потому что для манифестации необходимо гомозиготное состояние по аутосомным аллелям. Есть единственное исключение — Clinh (ингибитор C1–эстеразы): мутация этого гена, приводящая к дефициту продукта, проявляется в гетерозиготном состоянии фенотипом, известным под названием наследственного ангионевротического отёка (это редкий случай доминантной мутации).
Система комплемента предназначена для клиренса (очистки) циркулирующей крови от растворимых иммунных комплексов и корпускулярных — как иммунных комплексов, так и свободных бактерий. Соответственно недостаточность системы комплемента, если она касается первых 4 компонентов (C1–C4), проявляется в болезнях иммунных комплексов — системных васкулитах и повреждениях почек, что обобщенно называют синдромом системной красной волчанки (СКВ). Дефицит C3, а также факторов H и I ассоциирован с повышенной восприимчивостью к пиогенным инфекциям. Дефицит компонентов, участвующих в альтернативном пути активации комплемента, а также дефицит компонентов C5–C8 ассоциированы с повышенной восприимчивостью к инфекции, вызываемой Neisseria spp. Дефицит C9 клинически бессимптомен.
Полный дефицит C4 встречается крайне редко ещё и потому, что есть два гена С4А и С4В. Описано всего 25 случаев полного дефицита по C4. Все они имели клинику тяжёлой СКВ. Дефицит C2 встречается часто — 1 случай на 200 человек основной популяции. В 50% случаев полный дефицит C2 бессимптомен, в 50% — имеет симптоматику СКВ от слабовыраженной (дискоидная СКВ) до средней степени выраженности и тяжёлой форм. Дефицит C3 проявляется также в симптомах СКВ, но ещё и в повышенной восприимчивости к пиогенным бактериям. СКВ, как правило, прогрессирует до тяжёлых форм нефрита, так как в связи с повышенной чувствительностью к инфекции в крови увеличено и содержание иммунных комплексов.
Дефекты компонентов альтернативного пути активации системы комплемента — фактора В, пропердина и фактора D — клинически напоминают дефицит C3.
Кратко суммируем данные в табл. 11.4.
Таблица 11.4. Клинические проявления дефектов отдельных компонентов системы комплемента
| Известные дефекты компонентов | Клинические проявления |
| C1q | СКВ с гломерулонефритом |
| C1r | СКВ |
| C4 | То же |
| C2 | У 50% больных СКВ |
| C3 | Пиогенные инфекции, СКВ с гломерулонефритом |
| Фактор D | Инфекция, вызванная Neisseria spp |
| Фактор P (пропердин) | (?) Инфекция, вызванная Neisseria spp |
| Фактор H | Пиогенные инфекции, СКВ с гломерулонефритом |
| Фактор I | То же |
| C5 | Инфекция, вызванная Neisseria spp |
| C6 | То же |
| C7 | « « |
| C8 | « « |
| C9 | Бессимптомно |
| C1inh | Наследственный ангионевротический отёк |
| DAF | Гемолиз с пароксизмальной ночной гемоглобинурией |
| CD59 | То же |
| CR3 | Пиогенные инфекции |
· Глава 12
ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ
Вспомним существенную закономерность онтогенеза иммунной системы: иммунная система растёт и развивается как в плане количества лимфоцитов, так и в плане разнообразия репертуара антигенраспознающих Рц в течение вовсе не всей жизни. Она часть животного организма и растёт только тогда, когда растёт организм как целое, т.е. в детстве и до пубертатного возраста —· в среднем до 15 лет. Накопленное к 15 годам количество клонов лимфоцитов в течение оставшейся взрослой жизни лишь поддерживается «фоновой» пролиферацией и расходуется в процессе продуктивных иммунных ответов на патогены, проникающие во внутреннюю среду организма. То, что генерация новых клонов лимфоцитов не происходит у взрослых организмов, следует из фактов невозможности восстановления разнообразия репертуара антигенраспознающих Рц, а часто и количества лимфоцитов после воздействий на организм, приводящих к уничтожению больших количеств лимфоцитов (облучение, лимфотропные вирусные инфекции и др.). То есть после ампутации лимфоцитов тем или иным способом они не «отрастают» как новые точно так же, как не «отрастает» заново ампутированная нога или любой паренхиматозный орган. То, что каждый лимфоцит запрограммирован на пролиферацию клона при иммунном ответе, не означает пожизненную неограниченность потенциала лимфопоэза: он ограничен возрастом —15 лет. Поэтому существуют вторичные (или приобрётенные) иммунодефициты (ВИД).
Если от рождения здоровый организм со здоровой иммунной системой в постнатальном возрасте подвергается определённым патогенным воздействиям, которые физически повреждают большое количество лимфоцитов, в результате возникает вторичный иммунодефицит. Есть системные патологические состояния, которые вызывают не столько физическую гибель лимфоцитов, сколько функциональный «парез» иммунной системы. Это тоже ВИД. Но в отличие от ВИД с физическим повреждением лимфоцитов функциональный «парез» или дисфункция иммунной системы может быть обратима в случае, если причинное заболевание излечимо и продолжалось не слишком долго.
Исследование иммунной системы у человека при подозрении на ВИД предполагает определение ряда лабораторных показателей в периферической крови, как и при врождённых иммунодефицитах [анализ на ВИЧ–инфекцию; формула крови; уровень IgG, IgA, IgM в сыворотке; кожные пробы ГЗТ на широко распространённые микробные Аг (разработаны специальные тест–системы типа CMI Multitest™], если надо — подсчёт субпопуляций T– и B–лимфоцитов; по специальным показаниям — анализ состояния фагоцитов (наиболее простой и информативный анализ — тест на восстановление тетразолиевого голубого красителя); по специальным клиническим показаниям — анализ на содержание компонентов комплемента (начинают с C3 и C4) или иные анализы в зависимости от характера клинических симптомов.
12.1. Этиологические факторы
I. Факторы, вызывающие обратимые дисфункции (иммунодефицит) иммунной системы (обратимость в данном случае относительная и зависит от силы и продолжительности воздействия патогенного фактора):
1) чрезмерное голодание или дефицит в диете жизненно важных компонентов;
2) курабельные болезни метаболизма (диабет, синдром Иценко–Кушинга, дисфункция паращитовидных желёз и т.д.);
3) психическая депрессия;
4) курабельная ожоговая болезнь;
5) временный дистресс любой природы.
II. Факторы, вызывающие физическую «ампутацию"(в той или иной степени) лимфоидной ткани (и следовательно, необратимый иммунодефицит):
1) ВИЧ–инфекция;
2) повреждение иммунной системы при других инфекциях (гиперстимуляция иммунной системы суперантигенами при вирусных, грибковых и бактериальных инфекциях, а также по иным механизмам) — корь, гепатиты, цитомегаловирусные инфекции: краснуха, инфекция, вызванная вирусом Эпштейна–Барр, стафилококковые инфекции, туберкулёз, лепра, кокцидиомикоз, аспер-гиллёз и др.;
3) ионизирующая радиация в сверхпороговых дозах;
4) химические вещества с лимфотоксическим действием;
5) лимфопролиферативные заболевания; возможно, и некоторые другие злокачественные опухоли.
Рассмотрим только повреждения иммунной системы при инфекциях, потому что инфекции — естественные и главные «партнёры» иммунной системы, она против них создавалась в природе, поэтому они направленно эволюционируют в сторону приобретения самых разных способностей к выведению из строя именно иммунной системы. Поэтому при всякой патогенной инфекции в организме идёт борьба между системами резистентности, в том числе иммунной, и патогеном. Патогенных инфекций, не повреждающих иммунную систему так или иначе, не бывает. Распространённый механизм повреждения иммунной системы патогенами — гиперстимуляция иммунной системы суперантигенами патогенов и массовая поликлональная гибель (апоптозом) активированных лимфоцитов. Своими иммунодепрессивными свойствами известны вирусы группы герпес: вирус Эпштейна–Барр (EBV), цитомегаловирусы (CMV), герпесвирусы человека 6–го и 7–го типов (HHV–6, HHV–7) и др. У герпесвирусов существует много приёмов иммунодепрессии.
Вирусные белки обладают прямым сродством к молекулам MHC клеток человека и, «залипая» на молекулах MHC, препятствуют и распознаванию Аг T–лимфоцитами, и эффекторной работе ЦТЛ и NK. Кроме того, прямые опыты in vitro показывают, что, например, CMV и EBV значительно подавляют продукцию цитокинов активированными T–лимфоцитами, и иммунный ответ не развивается. Кроме того, известен антиапоптозный эффект неких белков EBV (гены которых вирус позаимствовал у клеток человека и включил в свой геном — этот механизм характерен для эволюции вирусов вообще) в отношении B–лимфоцитов человека. Но при этом B–лимфоцит не способен к нормальному функционированию: вирус подчиняет лимфоцит себе для нужд вирусной репликации, а в качестве отдаленных последствий возникает B–лимфома.
Разные вирусы, оказавшись в одной клетке, способны к активной генетической рекомбинации между собой, что увеличивает шансы каждого из них в борьбе за выживание с нашим организмом. Ещё один сильный биологический приём вирусов — образование псевдовирионов. Псевдовирионы — это вирионы, содержащие геном одного вируса, а оболочку другого. Оболочка обеспечивает тропизм инфекта к тем или иным клеткам. Поэтому, одевшись в чужую оболочку, инфекционное начало вируса — геном проникает в новые для себя (но свои для оболочки) клетки–мишени.
12.2. Синдром хронической усталости
Любой человек знает, что после инфекционных болезней, особенно тяжёлых, организм оказывается ослабленным. У некоторых людей после вирусных инфекций — герпесвирусных энтеровирусных, (varicella, EBV), краснухи, эпидемического паротита, а также в исходе острого периода токсоплазмоза, бруцеллёза и других инфекций развивается синдром хронической усталости(СХУ). Этот синдром может продолжаться до 6 мес и более. Он выражается в резкой утомляемости от минимальных нагрузок (например, от 2–3 простых гимнастических упражнений), ощущении потери трудоспособности уже с утра и до вечера, нарушенном сне, сне, не приносящем ощущения отдыха, заметном ухудшении памяти и способности концентрировать внимание. Это явление иллюстрирует сильные взаимные влияния ЦНС и иммунной системы. Есть данные о том, что инфузии препаратов донорских иммуноглобулинов способны заметно, но временно, улучшить состояние пациента с СХУ. Этот метод, однако, ни в коем случае не может быть рекомендован для лечения СХУ в связи с риском заражения смертельной ВИЧ–инфекцией и другими кровяными инфекциями. Но это показывает прямое влияние факторов иммунной системы на состояние ЦНС. О том же свидетельствует существенно повышенная частота атопии у людей с СХУ — 50–80% (по сравнению с 20–30% в общей популяции).
Принятая в мире тактика лечения СХУ заключается в дозированных систематических нагрузках, оптимальной диете, применении психотропных препаратов антидепрессивного действия, если есть симптоматика (амитриптилин и др.), мягких снотворных, поддерживающей психологической терапии.
12.3. Синдром приобрётенного иммунодефицита (СПИД), вызванный ретровирусами иммунодефицита человека (ВИЧ)
В 1981 г. в июне в Центр по контролю за заболеваемостью (CDCP) в Атланте (США) поступило два сообщения от двух разных врачей из различных городов о 5 пациентах (в сумме) с заболеванием, которое поразило специалистов в CDCP новизной клинической картины и исхода настолько, что по 5 случаям была введена новая нозологическая форма, названная синдромом приобрётенного иммунодефицита(СПИД). Заболевшие были молодыми мужчинами-гомосексуалистами, имевшими половые контакты один с другим (это навело на мысль об инфекционности болезни). Они умерли от грибковой пневмонии (возбудитель Pneumocystis carinii). При анализе крови у них было выявлено практически полное отсутствие CD4+ T–лимфоцитов, но при этом ничто в анамнезе не указывало на врождённый иммунодефицит. По 5 случаям CDCP объявил национальную готовность в отношении нового инфекционного заболевания. К августу 1981 г. в CDCP поступила информация ещё о 111 подобных больных. С этого момента началась регистрируемая эпидемия СПИДа.
К 1990 г. стало ясно, что это пандемия — первая в известной истории человечества. Заболевание имеет 100% летальность.
Здорового вирусоносительства за 25 лет наблюдения за эпидемией обнаружено не было, в связи с чем название нозологической единицы Всемирная организация здравоохранения заменила со СПИД на ВИЧ–инфекцию. СПИД — клиническое проявление терминальной фазы ВИЧ–инфекции.
Пандемия означает, что, распространяясь в новые регионы, болезнь не уходит из ранее ею захваченных и не идёт там на убыль. За 10 лет она распространилась по всей планете, пока ещё неравномерно, но процесс «выравнивания» идёт. От неё некуда уехать. Пандемия означает также, что ни отдельные индивидуумы, ни популяция людей (вид) не могут санировать себя от ВИЧ природными биологическими механизмами. Собственно поэтому имеет смысл сосредоточить внимание на ментальных механизмах защиты от инфекции.
СПИД — новое инфекционное заболевание, которого не было ни в XIX в., ни в начале XX в., оно начало распространяться среди людей только со второй половины XX в. (возможно, с конца 30–50-х годов, но большинство специалистов полагают, что с начала 70-х годов). Признание факта новизны существенно по двум причинам. Если думать, что это заболевание могло быть и раньше, только диагноз ставить не умели, то это чревато выводом, что можно ничего специального в связи с ВИЧ не предпринимать. Но это не так, этой болезни раньше не было. Второй вывод из признания факта новизны состоит в том, что принятые до того медицинские правила работы могут быть полностью непригодны в отношении нового заболевания. И это так.
· Первый аргумент в пользу новизны — факт открытия заболевания по клинической картине всего 5 случаев. Если бы такая клиника под разными другими названиями была привычна для врачей, никого бы не удивили 5 случаев настолько, что была введена новая нозологическая единица (к сожалению, не ошиблись).
· Второй аргумент — распределение по полам между мужчинами и женщинами. Несколько лет от начала эпидемии более 90% заболевших были мужчины. К концу первой декады соотношение между мужчинами и женщинами выровнялось до 1:1. Это значит, что сцепленных с полом ограничений в заболеваемости нет. Но, кроме того, это означает, что инфекция «пошла по людям» недавно. Если бы она персистировала давно, то давно бы установилось «равенство» между мужчинами и женщинами.
· Третий аргумент — взрывной характер манифестации заболевания во вновь осваиваемых инфекцией регионах: в течение 10–15 лет вирус накапливается в популяции без клинической манифестации. Но 10–15 лет — это средний период от момента заражения индивидуума ВИЧ до клинической манифестации. Предпоследний пример взрывного накопления регистрируемых случаев — страны Азии (особенно Юго-Восточной Азии и Индии). Ближайший ожидаемый регион — Россия (мы были последними «в очереди» по накоплению ВИЧ в популяции, но, увы, догоняем остальных).
12.3.1. Этиология
Этиология заболевания как пандемической инфекции человека включает два компонента: 1) вируc–возбудитель; 2) антропогенные факторы эпидемии. Антропогенные факторы эпидемии нельзя не учитывать, иначе наша реакция на эпидемию будет неадекватной. Аналогичные ретровирусы существуют у животных. Заражённые особи, семьи и популяции животных также вымирают, но пандемии у диких животных нет. А у людей есть. Следовательно, человеческий фактор существен.
Вируc–возбудитель был выделен в 1983 г. в США коллективом лаборатории Роберта Галло и параллельно их французскими коллегами. На его изучение в связи со смертельной опасностью заболевания западные страны потратили и продолжают тратить большие средства. Вирус изучен как ни один другой, с подробностями «вдоль и поперёк» (рис. 12.1). Это ретровирус, его геном — две цепи РНК. Вирус имеет специальный фермент — обратную транскриптазу (RT — reverse transcriptase), который, после того как вирус проникает в клетку–мишень, синтезирует ДНК по матрице вирусной РНК (т.е. RT — это ДНК–полимераза, использующая РНК в качестве матрицы и затравки). Второй вирусный фермент — интеграза — катализирует ковалентную интеграцию вирусной ДНК в несколько разных мест в геном человека. Интегрированную ДНК вируса называют провирусом. С этой ДНК идут синтезы мРНК для трансляции белков вируса и синтез геномной РНК вируса. Оболочка вируса — мембрана клетки человека, «инкрустированная» оболочечными белками вируса gp120 (самый наружный) и gp41 (трансмембранный). Фосфолипидная мембрана легко повреждается, что объясняет заблуждение: «лёгкая» инактивация вируса происходит под действием разных факторов во внешней среде. Мембрана действительно повреждается легко, но инфекционный потенциал заключается в РНК, а РНК устойчива к дезинфицирующим обработкам и способна к ренатурации после, например, термоденатурации.
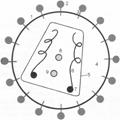
Рис. 12.1. Строение ВИЧ (схема). 1 — мембрана вируса — это мембрана клетки человека; 2 — оболочечный белок gp120; 3 — трансмембранный компонент оболочечного белка gp41; 4 — матрикс (p17; циклофилин); 5 — оболочка нуклеоида (p24); 6 — геном ВИЧ — две молекулы одноцепной РНК. Ферменты ВИЧ: 7 — обратная транскриптаза (RT); 8 — интеграза и РНКаза Н; 9 — протеаза.
Приведём список генов и белков ВИЧ (табл. 12.1). На рис. 12.2 показана схема расположения генов ВИЧ.
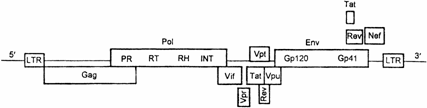
Рис. 12.2. Структура генома ВИЧ (схема). Гены ВИЧ в значительной степени «накладываются» друг на друга. Разные мРНК и соответственно разные белки образуются в результате действия альтернативных рамок считывания с физически одних и тех же последовательностей ДНК. LTR — long terminal repeate — длинные концевые повторы в 5'- и З'–концах провируса, синтезируются в процессе интеграции ДНК провируса в геном клетки. Структурные гены: Gag — group–specific antigens — группоспецифические Аг вируса — p24 и p17; Pol — polymerase — гены, кодирующие ферменты вируса: PR — протеазу, RT — обратную транскриптазу, RH — РНКазу Η, INT — интегразу; Env — envelope — гены белков оболочки вируса — gp120 и gp41. Регуляторные гены: Tat — transactivator of transcription — два экзона для белка трансактиватора транскрипции; Vif — virus infectivity factor — белок — «фактор инфекционности вируса"; Vpr — virus protein R — вирусный белок R; Vpu — virus protein U — вирусный белок U; Vpt — virus protein T — вирусный белок T; Rev — regulator of virus — белок–"регулятор вируса"; Nef — negative factor — фактор негативной регуляции вируса.
Таблица 12.1. Гены и белки ВИЧ–1
| Ген | Белок | Функции |
| env | gp120 | Самый наружный белок, обеспечивает связывание с клетками–мишенями. Лиганды — молекула CD4; галактозилцерамиды; Рц для цитокинов |
| gp41 | Обеспечивает интернализацию вириона в клетку | |
| gag | p24 | Составляет оболочку ядра вируса (нуклео-капсида) |
| p17 | Составляет матриксное вещество вируса | |
| p9 | Связан с геномной РНК | |
| p7 | То же | |
| pol | p66 | Обратная транскриптаза (RT, синтез ДНК по матрице РНК) |
| p31 | Интеграза (встраивает ДНК вируса в клеточный геном) | |
| p10 | Протеаза (расщепляет большие белковые трансляты на дефинитивные белки вируса) | |
| tat | p14 | Активирует транскрипцию с вирусных генов, стабилизирует вирусную мРНК, усиливает трансляцию с вирусной мРНК |
| rev | p19 | Существен для экспрессии белков оболочки (Env) |
| nef | p27 | (?) Может усиливать и ингибировать репликацию ВИЧ |
| vif | p23 | Необходим для выхода новорождённых вирусов из клетки–мишени (вероятно, участвует в фолдинге белков Env) |
| vpu | p16 | Необязателен для жизненного цикла вируса; усиливает отпочковывание вируса из клетки–мишени |
| vpr | p15 | ? |
Размер генома вируса около 10 тыс. нуклеотидов, частота точечных мутаций около 10–4, т.е. каждый первый дочерний вирион несет хотя бы одну мутацию. Столь высокая генетическая изменчивость характерна для РНК–содержащих вирусов и является их главным биологическим механизмом приспособления к выживанию в сильно меняющихся условиях внешней среды. Ретровирусы — не главные лидеры по изменчивости, но по совокупности своих патогенных свойств они впереди других. Подсчитано, что в теле инфицированного больного на бессимптомной стадии развития болезни содержится до 106 генетических вариантов вируса (квазивидов), на стадии манифестировавшего СПИД — около 108 вариантов. Цикл репликации вируса занимает порядка 10 ч. Вирус цитопатогенен; это означает, что после выхода вирионов из клетки последняя разрушается.
Инфекция ВИЧ является генерализованной инфекцией всего организма, потому что разные квазивиды вируса со временем осваивают многие типы клеток в организме. У каждого конкретного пациента в те или иные периоды развития болезни в клинической картине может преобладать преимущественное поражение вирусом той или иной ткани, но у большинства наблюдается сочетанное поражение разных тканей. Для инфекции в клетку ВИЧ использует молекулу мембран клеток человека CD4, а также Рц для хемокинов семейства «CC» (RANTES, MIP–1a, MIP–1b) и CXC — CCR 1,3,5 и CXCR4. Весьма вероятно, что вирус способен инфицировать клетки и через другие молекулы клеточных мембран.
ВИЧ инфицирует нейроны, CD4+ T–лимфоциты, клетки эндотелия, дендритные клетки, моноциты/макрофаги, фибробласты, B–лимфоциты, CD8+ T–лимфоциты (по крайней мере при коинфекции вирусами HHV–6, HTLV–1), стволовые кроветворные клетки, промиелоциты, мегакариоциты, хондроциты. Создаётся впечатление, что на каждый тип клеток организма человека рано или поздно по мере прогрессирования инфекции найдется квазивид ВИЧ, способный их инфицировать. У инфицированного человека вирус присутствует во всех тканях, включая экзосекреты и продукты выделения (сперма, слизистые секреты, слюна, пот, ушная сера, моча, экскременты и т.д.).
Пути трансмиссии вируса (пути заражения) следующие: парентеральное введение крови или продуктов крови, слизистые контакты, трансплацентарно, грудное вскармливание.
Антропогенные факторы пандемии по крайней мере следующие:
· широкое распространение (практически глобальное) гемотрансфузий и медицинское применение продуктов из человеческой крови;
· обобществленный медицинский инструментарий для манипуляций на слизистых оболочках (эндоскопы и др.);
· массовый трансконтинентальный транспорт;
· высокая концентрация населения в больших городах;
· полигамные сексуальные отношения;
· вероятно массовое введение с вакцинными препаратами людям продуктов, содержащих компоненты тканей животных (занос ретровирусов животных, что создало возможность эволюционирования их в адаптированные к человеку варианты).
12.3.2. Клиническая картина
Между моментом заражения и временем появления характерных клинических симптомов ВИЧ–инфекции существует скрытый, бессимптомный период развития болезни. Одно из самых трудных для человека свойств этой инфекции — сильно различающийся по продолжительности у разных людей инкубационный период. Продолжительность последнего зависит от дозы полученного при заражении вируса, исходного состояния здоровья человека, наличия других вирусных и бактериальных инфекций, образа жизни. Среднестатистически распределение пациентов по продолжительности инкубационного периода ВИЧ–инфекции выглядит следующим образом:
· у 10% болезнь развивается до стадии СПИД в первые 2–3 года от момента заражения. Таких пациентов называют быстрыми прогрессорами;
· у 80–85% людей болезнь развивается до стадии СПИД в пределах 10 лет. Таких пациентов называют типичными прогрессорами;
· у 5–10% инфицированных людей клинические симптомы отсутствуют в течение 7–10 лет и сохраняется стабильный уровень Т4–лимфоцитов в крови. Таких пациентов называют непрогрессорами.
Клинически болезнь классифицируют на 3 категории (по реестру CDCP) по манифестации индикаторных болезней и числу CD4+ T–лимфоцитов в периферической крови (табл. 12.2).
Самым ранним проявлением острой ВИЧ–инфекции, которое удаётся диагностировать приблизительно в 70% случаев, бывает гриппоподобный синдром. Его симптомы: лихорадка, фарингит, лимфаденопатия, артралгия, миалгия, недомогание (вплоть до угнетения сознания), анорексия. Со стороны нервной системы: головная и ретроорбитальная боль, симптомы менингоэнцефалита, периферическая нейропатия, радикулопатия, брахиальные невриты, когнитивные и аффективные расстройства. Со стороны кожи: эритематозная макулопапулярная сыпь, розеолоподобная сыпь, диффузная крапивница, десквамация, алопеция, кожно-слизистые ульцерации. Со стороны ЖКТ: кандидоз ротовой полости и глотки, тошнота, рвота, диарея. Со стороны дыхательной системы — кашель.
Таблица 12.2. Классификация клинических стадий (1–3) и категорий (А, В, С) ВИЧ–инфекции (по CDCP от 1993 г.)
| Клиническая категория | |||
| А | В | С | |
| Концентрация CD4+ T–лимфоцитов в крови в 1 мкл | бессимптомная или с генерализованной лимфаденопатией | симптоматическая, но не такая, как С | СПИД |
| 1. >500 | A1 | В1 | C1 |
| 2. 200–500 | А2 | В2 | C2 |
| 3. <200 | A3 | В3 | C3 |
Гриппоподобный синдром саморазрешается и наступает многолетний бессимптомный период.
Индикаторные болезни клинических категорий А, В и С по данным CDCP от 1993 г. и динамика их манифестации приведены в табл. 12.3.
Таблица 12.3. Ориентировочная типичная динамика манифестации индикаторных заболеваний при СПИД
| Состояние, система органов | Время после заражения | |||
| первые 10 нед | первые 5 лет | 10 лет | после 10 лет | |
| Общее самочувствие | Лихорадка, фарингит, лимфаденопатия, артралгия | Прогредиентное утрата дееспособности в различной степени у разных людей в зависимости от скорости прогрессии ВИЧ–инфекции | ||
| Кожа | Эритематоз, макулярная сыпь, крапивница, десквамация | Дерматомикоз, себорейный дерматит | Контагиозный моллюск, герпec опоясывающий, кандидоз полости рта, саркома Капоши, бородавки | Саркома Капоши |
| ЦНС | Головная боль, менингоэнцефалит, синдром Гийена–Барре | Демиелинизирующая нейропатия, парезы, параличи | Деменция, лимфома мозга, нейропатии | |
| ЖКТ | Изъязвления слизистых оболочек, кандидозы, диарея | Синдром Шёгрена, бактериальные гастроэнтериты, лейкоплакия полости рта | Гастроинтестинальные кандидозы, неходжкинские лимфомы | Кандидоз пищевода, персистирующая инфекция HSV, криптоспороидоз, цитомегаловирусный энтерит |
| Глаза | Синдром Шёгрена | Микроваскулопатия, HSV–кератит, неврит зрительного нерва | CMV–ретинит, токсоплазмоз | |
| Инфекции | Туберкулёз, кандидоз, токсоплазмоз, пневмония Pneumocystis carinii, криптоспороидоз, криптококкоз, цитомегаловирусные инфекции, разные микобактериальные инфекции | |||
| Система крови | "Атипичные» лимфоциты | Персисти-рующая генерализованная лимфаденопа-тия, CD8+–лимфоцитоз | Лимфомы | Анемия, тромбоци-топения |
Категория А. Бессимптомная. Либо персистирующая дольше 3 мес генерализованная лимфаденопатия без видимых признаков других инфекций.
Категория В.
· Бациллярный ангиоматоз. Кандидоз орофарингеальный.
· Кандидоз вульвовагинальный, персистирующий, торпидный к традиционной терапии.
· Цервикальная дисплазия или цервикальная карцинома. Лихорадка (38,5 °C) или/и диарея более 1 мес. Лейкоплакия полости рта.
· Герпеc опоясывающий, более двух эпизодов в год. Тромбоцитопения. Листериоз.
· Пельвиоцеллюлит, тубоовариальные абсцессы.
Категория С.
· Кандидозы бронхов, трахеи, лёгких.
· Кандидоз пищевода.
· Цервикальный рак, инвазивный.
· Кокцидиоидомикоз, диссеминированный или экстрапульмонарный.
· Криптококкоз, экстрапульмонарный.
· Криптоспороидоз, хронический кишечный (более 1 мес).
· Цитомегаловирусные инфекции (за пределами печени, селезёнки, лимфатических узлов).
· Цитомегаловирусный ретинит с потерей зрения.
· ВИЧ–энцефалопатия.
· Простой герпес: изъязвления долее 1 мес, с локализацией в бронхах, лёгких или пищеводе.
· Гистоплазмоз, диссеминированный или экстрапульмонарный.
· Изоспориоз, хронический кишечный (более 1 мес).
· Саркома Капоши.
· Лимфома типа Бёркетта.
· Лимфома иммунобластная.
· Лимфома мозга, первичная.
Mycobacterium avium, M. kansasii, диссеминированные или экстрапульмонарные.
Mycobacterium tuberculosis любой локализации (лёгочной или экстрапульмонарной).
Микобактерии любых других видов, диссеминированные или экстрапульмонарные.
Пневмония Pneumocystis carinii.
Пневмония рекуррентная (>2 эпизодов в год).
Прогрессивная мультифокальная лейкоэнцефалопатия.
Рекуррентная септицемия, вызываемая сальмонеллами.
Токсоплазмоз мозга.
ВИЧ–wasting–синдром (синдром истощения).
Динамика содержания в крови CD4+ T–лимфоцитов показана на рис. 12.3.
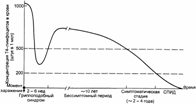
Рис. 12.3. Динамика содержания CD4+ T–лимфоцитов в крови ВИЧ–инфицированных пациентов. Ранняя фаза — гриппоподобный синдром, 2–6 нед при заражении большой дозой вируса; клинически бессимптомный период (продолжается в среднем 10 лет); симптоматическая стадия развития болезни (продолжается 2–4 года); СПИД — терминальная стадия развития болезни (продолжается 0,5–1 год).
Проявления иммунодепрессии начинаются задолго до клинической манифестации индикаторных болезней. Механизмы иммунодепрессии следующие.
На уровне CD4+ T–лимфоцитов.
1. Прямое цитопатогенное (разрушительное) действие ВИЧ на CD4+ T–лимфоциты.
2. Конкурентная блокада корецептора CD4 растворимым белком ВИЧ gp120.
3. Образование синцития.
4. Растворимый gp120, связываясь с неинфицированными Т4–лимфоцитами, превращает их в мишень для ЦТЛ и АЗКЦТ.
5. Суперантигены ВИЧ индуцируют поликлональную активацию и апоптоз T–лимфоцитов.
На уровне макрофагов.
1. Угнетение хемотаксиса.
2. Ухудшение функций АПК. Показано, что белок вируса Tat, трансактивирующий транскрипцию вирусных генов, значительно ингибирует транскрипцию и биосинтез молекул главного комплекса гистосовместимости MHC–I, следовательно, и противовирусные иммунные реакции.
3. «Ухудшение» фагоцитоза, опосредованного через Fc–peцептор.
4. «Ухудшение» всех макрофагальных бактерицидных механизмов.
На уровне CD8+ T–лимфоцитов. Лимфоцитоз, но постепенное ухудшение функционирования ЦТЛ.
На уровне NK. Ухудшение функционирования.
На уровне B–лимфоцитов и иммуноглобулинов. Поликлональная активация самим ВИЧ, а также EBV и CMV. Соответственно гипериммуноглобулинемия (особенно за счёт изотипов IgG1, IgG3, IgA, IgE), но снижение антительных функций сыворотки и способности к индукции антигенспецифичного гуморального ответа. Кроме этого, противовирусные АТ, связывая вирусы в комплекс, помогают им инфицировать все клетки, имеющие Fc–Рц (феномен усиления вирусной инфекции АТ).
На уровне клеток–предшественниц. ВИЧ инфицирует как стволовые кроветворные клетки, так и тимоциты и предшественники миелопоэза, чем «подсекает» кроветворение «на корню».
Кроме того, цитокины, стимулирующие развитие иммунного ответа, в ещё большей степени стимулируют репликацию ВИЧ: самым сильным стимулятором ВИЧ является TNF–a.
Динамика содержания в крови свободных вирионов, вирусных белков, противовирусных АТ и специфических анти–ВИЧ–ЦТЛ показана на рис. 12.4.
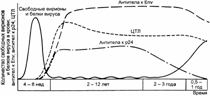
Рис. 12.4. Динамика содержания в крови ВИЧ–инфицированных пациентов свободных вирионов, АТ к ВИЧ, специфических ЦТЛ.
12.3 3. Лабораторная диагностика
Специфическая лабораторная диагностика — это определение в крови или биоптате лимфоидных тканей человека (или в любом биоматериале) следующих компонентов:
1) РНК и ДНК вируса (методом ПЦР в различных модификациях);
2) противовирусных АТ (методами иммунохроматографии или иммуноферментного анализа, в том числе методом иммуноблоттинга);
3) белков вируса (ловушечным иммуноферментным анализом);
4) высев живого реплицирующегося вируса в культуру клеток in vitro.
Какой из лабораторных методов определения наличия инфекции в организме пациента разумно применять в конкретных случаях — это не простой вопрос и вопрос для специалиста, так как следует учесть, когда произошло заражение, известно ли это или приходится только предполагать, возможные генетические субтипы вируса в зависимости от источника заражения (африканские, североамериканские, азиатские) и их соответствие имеющимся в наличии диагностическим тест–системам. Например, свободные вирусные белки (p24, gp120) можно обнаружить в крови человека в 1-е сутки манифестации гриппоподобного синдрома острой ВИЧ–инфекции. И это единственная возможность специфической лабораторной диагностики, но только в данный момент времени. АТ в этот период в определимых количествах ещё нет.
Через 1–2 сут перестанут определяться и свободные вирусные Аг, так как появляющиеся АТ свяжут их в комплексы. Методы анализов с диссоциацией иммунных комплексов в исследовательских целях применимы, но в диагностических целях могут подвести в силу «капризов» методик.
Если какой-то анализ показал наличие инфекции, то результат необходимо подтвердить на независимом диагностикуме и более чем одним независимым методом. Ложноположительные результаты возможны, но вероятность ошибки уменьшается с увеличением числа применяемых методов анализа. В конце концов по совокупности лабораторных данных можно прийти к определённому заключению о наличии ВИЧ–инфекции. Но обратное утверждение невозможно в принципе, т.е. сколько бы анализов ни было сделано конкретному человеку, утверждать, что в его организме отсутствует ВИЧ, нельзя. Это объясняется следующими причинами. Во-первых. Каждая конкретная диагностическая тест–система содержит реагенты, специфичные для уже известных ранее, выделенных изолятов ВИЧ. Но ВИЧ быстро эволюционирует в теле каждого пациента и, следовательно, в целом во времени. Значит, всегда есть вероятность, что у конкретного человека может доминировать в организме такой квазивид ВИЧ, который неузнаваем для диагностических тест–систем, имеющихся в распоряжении конкретной лаборатории. Во-вторых. Динамика накопления вируса в организме у каждого человека своя, и сроки сероконверсии (появления в крови специфических противовирусных АТ) колеблются от недель до лет от момента заражения. Но са
Дата добавления: 2016-07-18; просмотров: 4609;











