Кинетика ферментативных реакций
Кинетика ферментативных реакций определяется образованием фермент-субстратного комплекса:
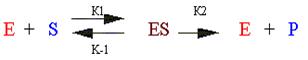
|
Где Е – фермент, S - субстрат, ES - фермент-субстратный комплекс, реакция образования которого обратима и характеризуется константами К1 и К-1 соответственно.
|
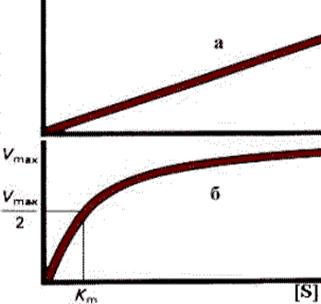
Рис. 2.2. Кинетика ферментативных реакций.
Распад фермент-субстратного комплекса протекает по уравнению первого порядка, он практически необратим и характеризуется константой скорости К2. Эта стадия процесса является более медленной, т.е. лимитирующей.
Начальная скорость (Vo). При обычных условиях, когда [S] > [E], начальная скорость прямо пропорциональна концентрации фермента. Максимальная скорость (Vmax). При фиксированной концентрации фермента, скорость реакции стремится к конечному максимальному значению, в то время как концентрация субстрата растет. Насыщение фермента субстратом наступает, когда весь фермент включен в фермент-субстратный комплекс.
Константа Михаэлиса (Km). В случае, когда все активные центры заняты, и свободные молекулы фермента отсутствуют, Vo=Vmax. При таком условии говорят о 100% насыщении. При 50% насыщении, когда Vo=1/2 Vmax из уравнения Михаэлиса - Ментен следует: Vmax / 2 = Vmax [S] / Km + [S], или в преобразованном виде: Km + [S] = 2 [S]; Km = [S]. Следовательно, Km имеет размерность концентрации. Таким образом, Кm – это такая концентрация субстрата, которая необходима для связывания половины имеющегося фермента и достижения половины максимальной скорости. Из этого определения следует, что Km можно использовать для оценки сродства фермента по отношению к данному субстрату.
Оценить субстратную специфичность можно по такому правилу: чем ниже значение Km, тем лучше (предпочтительнее) субстрат для данного фермента. Km и Vmax - кинетические параметры, отражающие механизмы действия фермента. Vmax отражает эффективность действия фермента. Для сравнения каталитической активности различных ферментов необходимо выразить Vmax через количество каждого фермента. Такое преобразование приводит к величине, которую называют молярной активностью (или числом оборотов фермента). Она выражается числом моль субстрата, реагирующего с одним моль фермента за единицу времени. Активность фермента можно выразить также в единицах (ед. или Е) активности. Одна единица катализирует превращение субстрата со скоростью1 мкмоль /мин. Удельная активность - это активность в единицах, отнесённая к 1 мг белка.
Дата добавления: 2019-02-08; просмотров: 734;











