Механизмы действия ферментов
Функции ФЕРМЕНТОВ
Функции ферментов сводятся к ускорению химических реакций, причем ферменты отличаются от других катализаторов тремя уникальными свойствами:
· высокой эффективностью действия;
· специфичностью действия;
· способностью к регуляции.
В соответствии с типами катализируемых реакций все ферменты разделены на шесть классов (табл. 2.1.). в основе классификации ферментов лежит специфичность их действия. Для некоторых ферментов используются ривиальные названия (пепсин, трипсин, уреаза, каталаза и др.).
Таблица 2.1. Классы ферментов
| Класс | Тип катализируемой реакции |
| Оксидоредуктазы | Окислительно-восстановительные реакции. |
| Трансферазы | Перенос отдельных групп атомов от донорной молекулы к акцепторной молекуле. |
| Гидролазы | Гидролитическое (с участием воды) расщепление связей. |
| Лиазы | Расщепление связей способом, отличным от гидролиза или окисления. |
| Изомеразы | Взаимопревращение различных изомеров. |
| Лигазы (синтетазы) | Образование связей в реакции конденсации двух различных соединений (используется энергия АТР). |
В живой клетке множество разнообразных соединений, но реакции между ними не беспорядочны, а образуют строго определенные метаболические пути, характерные для данной клетки. Индивидуальность клетки в большой степени определяется уникальным набором ферментов, который она генетически запрограммирована производить. Отсутствие даже одного фермента или какой-нибудь его дефект могут иметь очень серьезные отрицательные последствия для организма.
Кофакторы ферментов
Все ферменты относятся к глобулярным белкам, причем каждый фермент выполняет специфическую функцию, связанную с присущей ему глобулярной структурой. Однако активность многих ферментов зависит от небелковых соединений, называемых кофакторами. Молекулярный комплекс белковой части (апофермента) и кофактора называется холоферментом. Роль кофактора могут выполнять ионы металлов (Zn2+, Mg2+, Mn2+, Fe2+, Cu2+, K+, Na+) или сложные органические соединения. Органические кофакторы обычно называют коферментами, некоторые из них являются производными витаминов. Тип связи между ферментом и коферментом может быть различным. Иногда они существуют отдельно и связываются друг с другом во время протекания реакции. В других случаях кофактор и фермент связаны постоянно и иногда прочными ковалентными связями. В последнем случае небелковая часть фермента называется простетической группой.
Таблица 2.2. Некоторые коферменты и их роль
| Кофермент | Общая роль | Витамин предшественник |
| NAD+ , NADP+ | Перенос водорода (электронов) | Никотиновая кислота - витамин РР |
| FAD | Перенос водорода (электронов) | Рибофлавин - витамин В2 |
| Кофермент А | Активация и перенос ацильных групп | Пантотеновая кислота |
| Биотин | Связывание СО2 | Биотин |
| Пиридоксальфосфат | Перенос аминогрупп | Пиридоксин - витамин В6 |
| Тетрагидрофолиевая кислота | Перенос одноуглеродных фрагментов | Фолиевая кислота |
Роль кофактора в основном сводится к следующему:
· изменение третичной структуры белка и создание комплементарности между ферментом и субстратом;
· непосредственное участие в реакции в качестве еще одного субстрата.
В этой роли обычно выступают органические коферменты. Их участие в реакции иногда сводится к тому, что они выступают как доноры или акцепторы определенных химических групп.
Механизмы действия ферментов
Первоначальным событием при действии фермента является его специфическое связывание с лигандом - субстратом (S). Это происходит в области активного центра, который формируется из нескольких специфических R-групп аминокислот, определенным образом ориентированных в пространстве.
У некоторых ферментов в активном центре располагается и кофактор. Одни R-группы активного центра принимают участие в связывании субстрата, другие - в катализе. Некоторые группы могут делать и то, и другое. Детальный механизм действия каждого фермента уникален, но есть общие черты в «работе» ферментов, которые заключаются в следующем:
· высокая избирательность действия фермента обеспечивается тем, что субстрат связывается в активном центре фермента в нескольких точках и это исключает ошибки;
· активный центр располагается в углублении (нише) поверхности фермента и имеет комплементарную субстрату конфигурацию. В результате субстрат окружается функциональными группами активного центра фермента и изолируется от водной среды.
Связывание субстрата с ферментом часто вызывает конформационные изменения, что ведет к правильному (оптимальному) расположению аминокислотных остатков, требуемому для протекания катализа, и тем самым увеличивает специфичность фермент-субстратного взаимодействия (индуцированное соответствие). Так как максимальная активность фермента обусловлена оптимальной конформацией молекулы фермента в целом и активного центра в частности, то даже небольшие изменения окружающих условий, которые затрагивают связывание субстрата или конформацию третичной структуры белка, будут влиять на скорость ферментативной реакции. Например, изменение рН приводит к изменению степени ионизации ионогенных групп фермента и, следовательно, ведет к перераспределению межрадикальных связей в третичной структуре. Оптимальное рН для каждого фермента означает некоторое оптимальное состояние его ионизации, соответствующее наилучшей комплементарности. Изменение температуры вызывает противоречивый эффект:
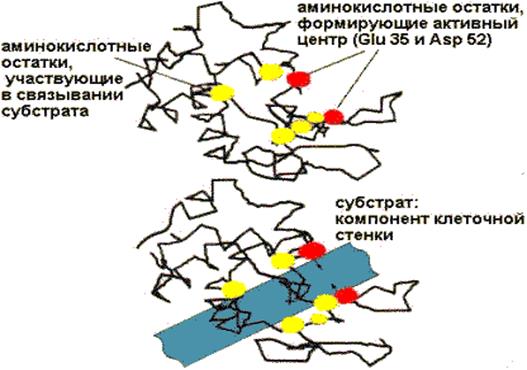 Рис. 2.1. Важнейшие аминокислотные остатки в активном центре лизоцима
Рис. 2.1. Важнейшие аминокислотные остатки в активном центре лизоцима
|
с одной стороны, при повышении температуры до 37 - 40о скорость ферментативной реакции увеличивается, что закономерно для катализа; с другой стороны, при температуре более 50о начинается денатурация фермента.
Дата добавления: 2019-02-08; просмотров: 740;











