Основные способы регуляции активности ферментов
Аллостерическая регуляция. Фермент изменяет активность с помощью нековалентно связанного с ним эффектора. Связывание происходит в участке, пространственно удаленном от активного (каталитического) центра. Это связывание вызывает конформационные изменения в молекуле белка, приводящие к изменению определенной геометрии каталитического центра. Активность может увеличиться - это активация фермента, или уменьшиться - это ингибирование (рис. 2.7).
«Сообщение» о присоединении аллостерического активатора передается посредством конформационных изменений каталитической субъединице, которая становится комплементарной субстрату, и фермент «включается». При удалении активатора фермент вновь переходит в неактивную форму и «выключается». Аллостерическая регуляция является основным способом регуляции метаболических путей.

|
Рис. 2.7. Аллостерическая активация фермента.
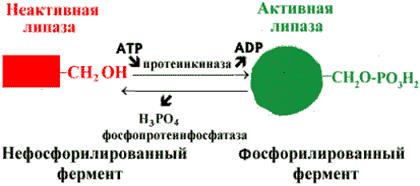 Регуляция активности липазы
Регуляция активности липазы
|
Регуляция активности ферментов путем фосфорилирования-дефосфорилирования. Фермент изменяет активность в результате ковалентной модификации (рис. 2.8). В этом случае фосфатная группа - ОРО32- присоединяется к гидроксильным группам в остатках серина, треонина или тирозина. В зависимости от природы фермента фосфорилирование может его активировать или, наоборот, инактивировать. Реакция присоединения фосфатной группы и ее отщепление катализируют специальные ферменты - протеинкиназы и протеинфосфатазы.
Регуляция путем ассоциации-диссоциации субъединиц в олигомерном ферменте. Этот процесс иногда начинается с ковалентной или нековалентной модификации одной из субъединиц. Например, фермент протеинкиназа в неактивной форме построена как тетрамер R2C2 (R и С - разные субъединицы). Активная протеинкиназа представляет собой субъединицу С, для освобождения которой необходима диссоциация комплекса. Активация фермента происходит при участии cAMP (циклоаденозинмонофосфорная кислота), которая способна присоединиться к субъединице R, после чего изменяется конформация, комплементарность субъединиц R и С и происходит диссоциация комплекса:
R2C2 + 2cАМР ® 2С + 2(R -сАМР)
Циклический АМР является продуктом АТР, превращение которой катализирует фермент аденилатциклаза:
АТР ® сАМР + Н4Р2О7
2.6. Аденилатциклазная система.
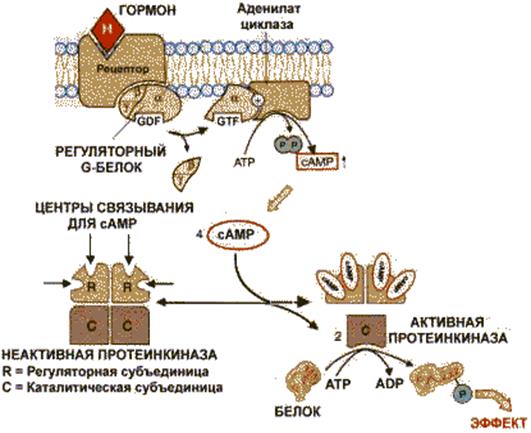
Аденилатциклаза и протеинкиназа катализируют взаимосвязанные реакции, которые составляют единую регуляторную систему (рис. 2.9).
|
Рис. 2.9. Аденилатциклазная система .
R – регуляторная субъединица; С – каталитическая субъединица.
С помощью этой системы в клетку передаются сигналы из внеклеточной среды, и в нужном направлении изменяется метаболизм клетки. Внеклеточным вестником сигнала могут быть разные молекулы, в том числе и гормоны. Эти молекулы не проникают внутрь клетки, но «узнаются» мембранными рецепторами. При активации аденилатциклазы происходят следующие этапы:
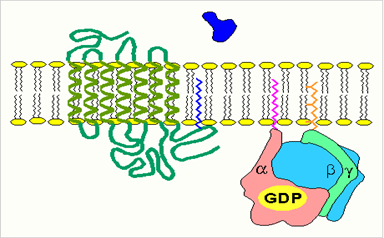
· изменение конформации рецептора после присоединения к нему сигнальной молекулы и увеличение его сродства к регуляторному G-белку. В результате образуется комплекс рецептора и протомеров G-белка;
· образование этого комплекса приводит к изменению конформации a -протомера G-белка, который теряет сродство к GDP и происходит замена GDP на GTP. В результате комплекс протомеров G-белка распадается;
· a -протомер взаимодействует с аденилатциклазой, что ведет к изменению ее конформации и как следствие этого - активации;
· после этого аденилатциклаза катализирует синтез cAMP, который в свою очередь активирует cAMP-зависимую протеинкиназу. Активация последней связана с диссоциацией комплекса входящих в нее протомеров после присоединения cAMP.
Протеинкиназа фосфорилирует соответствующие ферменты, изменяет их активность и, следовательно, скорость метаболизма в клетке.
Активация ферментов путем частичного протеолиза. Некоторые ферменты синтезируются первоначально неактивными и лишь после секреции из клетки переходят в активную форму. Неактивный предшественник называется проферментом. Активация профермента включает модификацию первичной структуры с одновременным изменением конформации. Например, трипсиноген, синтезированный в поджелудочной железе, затем в кишечнике превращается в трипсин путем удаления фрагмента с N-конца:
 Энтеропептидаза
трипсиногентрипсин трипсин + Val-(Acn)4 –Lys Энтеропептидаза
трипсиногентрипсин трипсин + Val-(Acn)4 –Lys
|
Расщепление определенных пептидных связей «запускает» новые взаимодействия R-групп по всей молекуле, приводя к новой конформации, в которой R-группы активного центра занимают оптимальное положение для катализа. Нарушения структуры какого-либо фермента, ведущие к снижению его активности, приводят к нарушению метаболических путей, в которых участвует этот фермент. Такие нарушения почти всегда проявляются как болезни. Повреждения ферментов бывают двух типов: наследственные дефекты строения фермента и повреждения, вызванные попадающими в организм токсическими веществами, ингибирующими фермент.
|
Дата добавления: 2019-02-08; просмотров: 1250;











