По наличию границы раздела фаз реакции могут быть гомогенные и гетерогенные.
6. По тепловому эффекту различают экзо- и эндотермические реакции.
7. Химические реакции могут протекать селективно (с образованием только одного из многих возможных продуктов) и неселективно (с образованием всех возможных продуктов).
Региоселективность– предпочтительное протекание реакции по одному из нескольких реакционных центров молекулы.
СН3—СН2—СН3 + Вr2 → СН3—СНВr—СН3 + НВr
Второй изомер, 1-бромпропан, практически не образуется.
 |
Хемоселективность – предпочтительное
протекание реакции по одной из
родственных функциональных групп.
 |
Стереоселективность –
предпочтительное образование
в реакции одного из нескольких
возможных стереоизомеров.
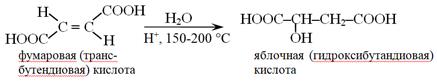
Гидратация фумаровой кислоты in vitro приводит к образованию рацемата – смеси равных количеств двух энантиомеров яблочной кислоты. В организме эта реакция катализируется ферментом фумаразой, для которого характерна строгая пространственная специфичность (стереоселективность), что ведет к образованию только L-яблочной кислоты.
8. В органической химии реакции часто классифицируют по частным признакам:
– гидратация – присоединение воды по двойной связи:
СН3–CH = CH2 + H2О ® СН3–CH(ОН)–CH3;
– дегидратация – отщепление воды с образованием непредельного соединения:
СН3–CH(ОН)–CH3 ® СН3–CH = CH2 + H2О;
– гидрирование – присоединение водорода по двойной связи:
СН3–CH = CH2 + H2 ® СН3–CH2–CH3 или СН3–CО–CH3 + H2 ® СН3–CH(ОН)–CH3;
– дегидрирование – отщепление водорода с образованием непредельного соединения:
СН3–CH2–CH3 ® СН3–CH = CH2 + H2
– нитрование – взаимодействие с азотной кислотой, в результате которого атом водорода в молекуле субстрата замещается на нитрогруппу:
СН3–CH3 + HNO3 ® СН3–CH2NO2 + H2O;
– галогенирование – взаимодействие с галогеном, при этом атом водорода в молекуле субстрата замещается на атом галогена или атомы галогена присоединяются по кратной связи:
СН4 + С12 ® СН3С1 + НC1 или CH2 = CH2 + Br2 ® CH2Br – CH2Br;
– дегалогенирование – отщепление молекулы галогена с образованием кратной связи или циклического соединения: CH2Br – CH2Br ® CH2 = CH2 + Br2;
– гидрогалогенирование – взаимодействие с галогеноводородом, в результате которого атомы водорода и галогена присоединяются по кратной связи:
CH2 = CH2 + HBr ® CH2Br–СH3;
– дегидрогалогенирование – отщепление молекулы галогеноводорода с образованием кратной связи: CH2Br–СH3 ® CH2 = CH2 + HBr;
– сульфирование – взаимодействие с серной кислотой или олеумом, в результате которого атом водорода в молекуле субстрата замещается на сульфогруппу:
СН3–CH3 + H2SO4 ® СН3–CH2SO3H + H2O;
– гидролиз – взаимодействие сложного субстрата с водой с образованием более простых соединений, например при гидролизе белков образуется смесь аминокислот.
– карбоксилирование – реакция, в результате которой в продукте реакции появляется карбоксильная группа; так в присутствии АТФ пировиноградная кислота в организме превращается в ацетоуксусную кислоту:
СН3–СО–СООН+СО2+АТФ ® НООС–СН2–СО–СООН+АДФ+ Н3РО4;
– декарбоксилирование – реакция, в результате которой от субстрата отщепляется карбоксильная группа в виде углекислого газа: R–CH(NH2)–COOH ® R–CH2NH2 + CO2;
– дезаминирование – отщепление от молекулы субстрата аминогруппы; в зависимости от условий реакции или типа действующего фермента могут протекать следующие реакции:
– окислительное дезаминирование, в результате которого аминогруппа замещается на оксогруппу: R–CH(NH2)–COOH + [O] ® R–СО–CООН + NH3;
– гидролитическое дезаминирование, в результате которого аминогруппа замещается на гидроксигруппу: R–CH(NH2)–COOH + H2O ® R–СН(ОН)–CООН + NH3;
– внутримолекулярной дезаминирование, в результате которого образуется непредельное соединение: R–CH2–CH(NH2)–COOH ® R–CH=CH–CООН + NH3;
– восстановительное дезаминирование, в результате которого аминогруппа замещается на атом водорода: R–CH(NH2)–COOH + [Н] ® R–CH2–CООН + NH3;
– дезаминирование in vitro под действием азотистой кислоты с образованием гидроксисоединений: R–CH(NH2)–COOH + НNО2 ® R–СН(ОН)–CООН + N2 + H2O;
 – изомеризация – превращение субстрата в изомер, т.е. соединение, имеющее тот же качественный или количественный состав, но другое строение:
– изомеризация – превращение субстрата в изомер, т.е. соединение, имеющее тот же качественный или количественный состав, но другое строение:
С классификацией реакций по частным признакам часто связаны названия ферментов. Так, ферменты, катализирующие окислительно-восстановительные реакции, называются оксидоредуктазы; реакции отщепления водорода (дегидрирования) катализируются дегидрогеназами; реакции декарбоксилирования ускоряют декарбоксилазы, а дезаминирования – дезаминазы; для того, чтобы в организме прошла реакция изомеризации потребуются изомеразы, а для реакции гидролиза необходимы гидролазы.
 Строение и свойства поли- и гетерофункциональных соединений
Строение и свойства поли- и гетерофункциональных соединений
Большинство органических веществ, участвующих в процессах
метаболизма, представляют собой соединения с двумя и более функциональ-
ными группами. Такие соединения принято классифицировать следующим образом:
1) полифункциональные, содержащие одинаковые функциональные группы, например: этиленгликоль СН2ОН – СН2ОН, щавелевая кислота НООС–СООН;
2) гетерофункциональные, содержащие различные функциональные группы, например: коламин СН2ОН–CH2NH2, пировиноградная кислота СН3–СО–СООН;
3) гетерополифункциональные, например: различные моносахариды, яблочная кислота.
Наличие нескольких функциональных групп в молекуле приводит к появлению нехарактерных для монофункциональных соединений специфических свойств, что очень важно для обеспечения биологических функций, выполняемых этими веществами в организме.
Многие гетерофункциональные производные бензола применяют в качестве лекарственных препаратов.
Кислотно-основные свойства. Общая закономерность: наличие в молекуле групп –ОН, –SH, –СООН приводит к усилению ее кислотных свойств, а аминогрупп – к усилению основных свойств. Наличие в молекуле групп, различных по кислотно-основным свойствам, обусловливает амфотерные свойства соединений. Предельным случаем является полный перенос протона от кислотного центра к основному, например в a-аминокислотах, которые в кристаллическом состоянии, а так же в нейтральном водном растворе существуют в форме цвиттер-иона (биполярного иона, внутренней соли): H3N+–CH(R) –COO–.
Нуклеофильно-электрофильные свойства. Общая закономерность: наличие электроноакцепторного заместителя облегчает протекание нуклеофильных реакций и затрудняет протекание электрофильных реакций. Так, в присутствии карбоксильной группы атом галогена, например в a- галогенкарбоновых кислотах, легко замещается не только на гидроксильную группу (при взаимодействии со щелочами), но и на аминогруппу (при взаимодействии с аммиаком): R–CH(Cl)–COOH + 3NH3 ® R–CH(NH2)–COONH4 + NH4C1
Реакции циклизации. Относятся к специфическим реакциям гетерофункциональных соединений и могут протекать как внутримолекулярно, так и межмолекулярно в зависимости от удаленности функциональных групп друг от друга.
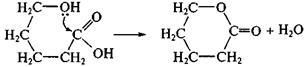
Внутримолекулярная циклизация. Общая закономерность: реакции характерны для гетерофункциональных соединений с g- и d-положением функциональных групп.
В результате реакций внутримолекулярной циклизации могут образоваться циклические полуацетали из альдегидоспиртов, циклические эфиры – лактоны – из гидроксикислот
 | |||
 | |||
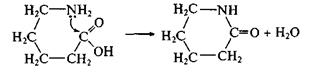
циклические амиды – лактамы – из аминокислот:
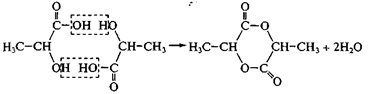
Межмолекулярная циклизация.
Выполняется общая закономерность:
реакции характерны для замещенных
кислот, проходят по механизму меж-
молекулярного элиминирования и со-
провождаются образованием устойчивых шестичленных циклов – циклических диэфиров – лактидов из a-гидроксикислот; например, образование лактида молочной кислоты или циклических диамидов – дикетопиперазидов из a-аминокислот.
Реакции комплексообразования. Выполняется общая закономерность: поли- и гетерофункциональные соединения с a-положением функциональной группы выступают в роли бидентатных или полидентатных лигандов при взаимодействии с ионами переходных металлов с образованием внутрикомплексных соединений – хелатов.
Реакции хелатообразования являются специфическим свойством поли- и гетерофункциональных соединений; чрезвычайно широко распространены и играют существенную роль в процессах метаболизма. Один из примеров – образование внутрикомплексной соли – глицината меди – при взаимодействии в растворе аминоуксусной кислоты с солями меди (II):
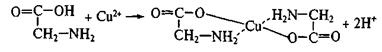
Связи, обозначенные пунктиром, образованы по донорно-акцепторному механизму.
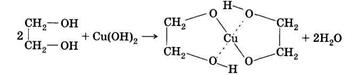 Эту реакцию используют как качественную при идентификации поли- и гетерофункциональных соединений. Реакцию проводят со свежеосаждённым гидроксидом меди (II), который представляет собой осадок голубого цвета. При добавлении, например, многоатомных спиртов (этиленгликоль, глицерин), осадок растворяется, т.к. образуется водорастворимый комплекс ярко-синего цвета:
Эту реакцию используют как качественную при идентификации поли- и гетерофункциональных соединений. Реакцию проводят со свежеосаждённым гидроксидом меди (II), который представляет собой осадок голубого цвета. При добавлении, например, многоатомных спиртов (этиленгликоль, глицерин), осадок растворяется, т.к. образуется водорастворимый комплекс ярко-синего цвета:
Хелаты представляют собой устойчивые циклические комплексные соединения. Большинство ионов биометаллов в организме находятся в виде хелатных комплексов с органическими биолигандами. Примерами таких соединений являются гем, хлорофилл, витамин В12, структуры которых представлены на рис. 7.
 |
Рисунок 7. Структуры гема (а), хлорофилла (б), витамина В12 (в).
Выведение ионов тяжелых металлов из организма под действием хелатирующих лигандов называется хелатотерапией. Чтобы выполнить функцию детоксикантов, вводимые комплексоны-лиганды должны отвечать ряду требований: быть нетоксичными; не подвергаться разложению или какому-либо изменению в биологической среде; эффективно связывать ионы-токсиканты, причем вновь образующиеся соединения должны быть более прочными, чем те, которые существовали в организме; не разрушать жизненно необходимые комплексы: гемоглобин, витамин В12, цитохромы и др.
Одним из первых лекарственных комплексонов, используемых в таких целях, был 2,3-димеркаптопропанол (британский антилюизит). Близок ему по структуре применяемый в России унитиол. Унитиол эффективно выводит из организма мышьяк, ртуть, хром, висмут; препарат менее перспективен при отравлениях свинцом.
В последнее время разработаны перспективные хелатообразующие средства, позволяющие избирательно выводить из организма те или иные ионы. Для удаления ионов железа используют, например, дефероксамин, для удаления меди – при острых отравлениях и гепатоцеребральной дистрофии – пеницилламин (2-амино-3-меркапто-3-метилбутановая кислота). Последний менее специфичен как лиганд: помимо ионов меди, он связывает также ионы ртути, свинца, что усиливает его достоинства, но также железа и кальция, что может вести к нежелательным последствиям из-за снижения концентрации этих металлов.
Высокой степенью комплексообразования отличается фитин – сложный органический препарат. Фитин полностью защищает животных, токсицированных смертельными дозами свинца. При этом фитин выводит яд преимущественно через желудочно-кишечный тракт, а не через почки, снижая нагрузку на этот жизненно важный орган.
Важную группу лекарственных препаратов составляют комплексы, в которых ионы-комплексообразователи выполняют роль не токсикантов, а лекарственных средств. К 2500 году до н.э. восходит история применения в медицине золота, которое использовали в Китае для лечения проказы. В настоящее время соединения этого металла употребляют в основном при лечении ревматоидного артрита, когда наиболее активные в физиологическом отношении атомы золота, в степени окисления +1, стабилизируются серосодержащими лигандами гидролитических ферментов, что блокирует разрушающее действие их на суставы.
Инертные, устойчивые хелаты золота обладают значительной антивирусной активностью. При этом они эффективны даже по отношению к тем из микроорганизмов, которые нечувствительны к влиянию антибиотиков. Существенно, что требующиеся для этого концентрации хелатов в большинстве случаев практически нетоксичны. Поэтому хелаты золота, а также цинка всё чаще используют для борьбы с вирусными инфекциями кожи и ран.
Токсический эффект некоторых комплексов реализуется при создании противораковых препаратов. Для разрушения раковых клеток особенно удачным оказалось применение соединений элементов восьмой группы: никеля, палладия и платины. Анионные комплексы платины (IV) оказывают бактерицидное действие (например, гексахлороплатинаты (IV)); нейтральные способны приостанавливать деление, но не рост клеток (например, цис-тетрахлородиамминплатина (IV)); цис-комплексы платины (II) обладают противоопухолевыми и лизогенными свойствами (например, цис-дихлородиамминплатина (II), цис-дихлородигидроксиламинплатина (II)). Использование некоторых из этих комплексов в качестве противораковых препаратов приводило к снижению смертности, повышению числа случаев полного излечения и давало иммунитет к опухолям, вызываемых канцерогенами и вирусами. При совместном использовании таких комплексов с другими лекарственными препаратами наблюдался синергический эффект, а вред, наносимый клеткам нормальных тканей, оказался возместимым. Положительное действие комплексных соединений в лечении раковых заболеваний, как правило, вызвано блокированием ими участков ДНК, принимающих участие в передаче генетической информации.
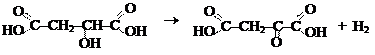 Задания для самостоятельной работы
Задания для самостоятельной работы
1. В организме протекает реакция:
К какому классу по изменению числа
частиц в ходе реакции и по частным признакам можно отнести эту реакцию? Можно ли назвать эту реакцию окислительно-восстановителоьной?
2. Привлекающим феромоном рабочей пчелы является гераниол. Установите строение молекул гераниола, если известны следующие его свойства: состав молекулы С10Н18О; при бромировании образует вещество 2,3,6,7-тетрабром-3,7-диметил-1-октанол.
3. Муравьи для подачи сигнала тревоги выделяют вещество состава С7Н14О. Определите строение этого вещества, если оно взаимодействует с гидроксиламином, а при каталитическом гидрировании образует 4-метил-3-гексанол.
4. У красноклопов роль феромона тревоги играет вещество состава С6Н10О. Установите его строение на основании следующих свойств: а) реагирует с аммиачным раствором оксида серебра, б) при озонолизе дает смесь масляного альдегида и диальдегида состава СОН-СОН.
5. Запах фиалок обусловлен веществом состава С9Н14О. Какова структурная формула этого вещества, если при бромировании образуется 2,3,6,7-тетрабромнонаналь?
6. Кисловатый вкус ягод барбариса обусловлен высоким содержанием вещества состава С4Н6О5. Каково строение этого вещества, если при его дегидратации образуется непредельная дикарбоновая кислота состава С4Н4О4?
7. Аромат лаврового листа обусловлен присутствием сложного эфира. Установите его структурную формулу, если известно, что при его гидролизе образуется лауриловый спирт СН3-(СН2)10-СН2ОН и лауриновая кислота СН3-(СН2)10-СООН.
8. В организме протекает реакция: CH3–CH(NH2)–COOH ® CH2=CH–CООН + NH3
К какому классу по изменению числа частиц в ходе реакции и по частным признакам можно отнести эту реакцию?
9. В процессе метаболизма в живых организмах фумаровая кислота превращается в яблочную. Напишите уравнение реакции. В виде каких стереоизомеров может существовать исходное соединение и продукт реакции? Какой из стереоизомеров образуется in vivo?
10. На одной из стадий биосинтеза хлортетрациклина в грибах осуществляется хлорирование фенольного фрагмента молекулы. Смоделируйте эту реакцию in vitro на примере хлорирования фенола. По какому механизму протекает данная реакция?
11. Одной из проб, подтверждающих подлинность парацетамола, является кипячение его с разбавленной серной кислотой, при этом ощущается запах уксусной кислоты. Напишите уравнение реакции, объясните появление запаха.
12. Оксалат кальция труднорастворим в воде, часто образует камни в почках и мочевом пузыре. Напишите уравнение его образования по реакции нейтрализации.
13. 1-Пропанол содержится в сивушных маслах, образующихся в небольшом количестве при спиртовом брожении. Напишите уравнение реакции окисления 1-пропанола в соответствующую кислоту. Какой промежуточный продукт образуется в ходе этой реакции?
14. Бензиловый эфир бензойной кислоты (бензилбензоат) – противочесоточное средство. Какие продукты образуются в результате реакции гидролиза этого сложного эфира в щелочной среде? Напишите уравнение реакции.
15. Яблочная кислота при нагревании отщепляет воду. Напишите уравнение реакции дегидратации яблочной кислоты, укажите тип реакции.
16. Проанализируйте строение следующих соединений: 1-пентанол, 2-пентанол; 2-метил-2-бутанол. Расположите эти спирты в ряд по увеличению основных свойств. Ответ поясните.
17. Проанализируйте строение следующих соединений: этанол, 1,2- этандиол, фенол, п-нитрофенол и п-аминофенол. Расположите их в ряд по увеличению кислотности. Ответ поясните.
18. Проанализируйте строение следующих соединений: глицерин, 1-пропанол, уксусная кислота. Расположите их в ряд по увеличению кислотности. Ответ поясните.
19. Проанализируйте строение следующих соединений: диметиламин, метиламин; аммиак, триметиламин. Расположите их в ряд по увеличению основных свойств. Ответ поясните.
20.Проанализируйте строение следующих соединений: пропановая кислота, 2-метилпропановая кислота и 2-бромпропановая кислота.Расположите их в ряд по увеличению кислотных свойств. Ответ поясните.
21. Альбуцид применяется в медицинской практике в виде натриевой соли. Определите центр кислотности в молекуле альбуцида и напишите его реакцию с гидроксидом натрия с образованием соли.
22. Норадреналин применяется в виде соли винной кислоты (норадреналина гидротартрат). Проведите сравнительную оценку силы основных центров в молекуле норадреналина. Укажите место протонирования.
23. При бромировании 3-метилпентана теоретически возможно получение четырёх монобромпроизводных, но образуется преимущественно одно органическое соединение: 3-бром-3-метилпентан и одно неорганическое – бромоводород. Напишите соответствующее уравнение. К какому классу по изменению числа частиц в ходе реакции можно отнести эту реакцию? К какому типу селективных реакций можно отнести эту реакцию?
24. В метаболизме a-аминокислот участвует гомосерин (2-амино-4-гидроксибутановая кислота) и его лактон. Напишите уравнение образования лактона гомосерина.
25. ГАМК (γ-аминомасляная кислота) принимает участие в обменных процессах, происходящих в головном мозге, является нейромедиатором. В медицинской практике под названием гаммалон,или аминалон,применяется в качестве ноотропного средства. Эта кислота является естественным метаболитом нашего организма, синтезируется из глутаминовой кислоты. Напишите уравнение реакции. Определите класс реакции по различным признакам.
26. Важное значение для медицины имеют производные лактама γ-аминомасляной кислоты (γ-бутиролактама, или 2-пирролидона). Производное 2-пирролидона под названием пирацетам (или ноотропил)рассматривается как первый представитель ноотропных средств. Напишите реакцию синтеза 2-пирролидона
27. В цикле Кребса при дегидратации лимонной кислоты получается цис-аконитовая кислота, которая далее гидратируется с образованием изолимонной кислоты. Напишите соответствующие уравнения реакций. Напишите структурную формулу пространственного изомера для цис-аконитовой кислоты.
28. Герои приключенческого романа «Таинственный остров» Жюля Верна используют тринитроглицерин для подрыва гранитной скалы. Автор подробно описывает процесс получения нитроглицерина из природных веществ, обнаруженных на острове (хотя Жюль Верн намеренно опустил один из важных этапов синтеза). Задания:
А. Напишите формулу глицерина и тринитроглицерина.
Б. Напишите уравнение и тип реакции получения из глицерина тринитроглицерина
В. Какие биологически важные соединения может образовывать глицерин?
Г. Назовите сферы жизни человека и области медицины, где можно использовать глицерин и нитроглицерин.
29. Вас покусали муравьи, когда вы собирали землянику в лесу. Место укусов чешется и болит. Почему болит место укуса? Напишите название вещества из домашней аптечки, которое вы можете использовать, чтобы уменьшить зуд и боль. Составьте уравнение реакции. Назовите тип реакции.
30. Можно ли отнести лимонную кислоту к полифункциональным соединениям? Какое количество вещества (моль) этанола необходимо ввести в реакцию, чтобы получить полный этиловый эфир лимонной кислоты? Напишите соответствующее уравнение реакции.
Вопросы для подготовки к тесту № 1
1. Знать классификацию реакций органических соединений.
2. Знать формулы и названия кислот, приведённых в списке (приложение 3). Кроме самих кислот знать названия их ионных форм: солей или эфиров (приложение 4).
3. Знать, какие реакции наиболее характерны для различных классов органических соединений (предельных, непредельных, ароматических и т.п.). Например:
Какой тип реакций характерен для свойств алкенов, обусловленных наличием двойной связи углерод–углерод:
а) радикального замещения; б) нуклеофильного присоединения;
в) электрофильного присоединения; г) электрофильного замещения?
4. Уметь писать уравнения реакции замещения (например, реакция галогенирования); присоединения галогена, воды или водорода по двойной или тройной связи (например, реакции взаимодействия брома с фумаровой кислотой), реакции дегидрирования и гидрирования.
Например:
1-Бромбутан гидролизуется водным раствором гидроксида натрия. Напишите соответствующее уравнение реакции.
5. Определять механизм, по которому протекают реакции, например взаимодействия брома с фумаровой кислотой, воды с яблочной кислотой, галогенпроизводного с водным раствором щёлочи, спирта с галогеноводородом, получения альдегида из спирта или спирта из альдегида (кетона), превращения молочной кислоты в пировиноградную или аланина в пропеновую кислоту.
6. Знать внешние признаки протекания и уметь писать уравнения реакций, исследованных в ходе лабораторной работы № 1. Например:
Напишите уравнение получения этаналя из этанола. Каков механизм этой реакции:
а) окисление этанола; б) окисление этаналя; в) разложение этанола;
г) восстановление этанола; д) восстановление этаналя
Каков внешний эффект взаимодействия олеата натрия с бромной водой:
а) обесцвечивание олеата натрия; б) обесцвечивание бромной воды;
в) выпадение белого осадка; г) выделение газа?
7. Знать определение оснований и кислот согласно теории Брёнстеда. Уметь писать уравнения реакции нейтрализации, например, между молочной кислотой и гидроксидом натрия.
8. Сравнивать кислотные и основные свойства органических соединений. Например:
Какая кислота имеет более сильные кислотные свойства: пропановая или 2-бромпропановая?
9. Различать следующие понятия: субстрат, реагент, реакционный центр, продукт реакции, указывать их на примере конкретной химической реакции. Например, написать реакцию взаимодействия олеата натрия с бромной водой и указать субстрат, реагент, реакционный центр, продукт реакции.
10. Уметь писать реакции хелатообразования (образования внутрикомплексной соли) для двухатомных спиртов и аминокислот.
11. Знать формулы и медицинское значение гетерофункциональных производных бензола, используемых в качестве лекарственных средств (см. Биоорганическая химия: учеб. для вузов. Авторы Тюкавкина Н.А., Бауков Ю.И., Зурабян С.Э.)
Дата добавления: 2020-07-18; просмотров: 1088;











