Влияние температуры на скорость химической реакции
Экспериментальные исследования химических реакций показывают, что при повышении температуры скорость реакции увеличивается. Так, например, скорость реакции соединения водорода с кислородом при температуре 300◦С неизмеримо мала; а при 700◦С эта реакция идет с громадной (взрывной) скоростью.
Количественная оценка влияния температуры на скорость реакции, а, следовательно, и на константу скорости оценивается температурным коэффициентом скорости реакции 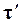 . Температурный коэффициент скорости равен отношению констант скоростей
. Температурный коэффициент скорости равен отношению констант скоростей
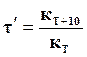 .
.
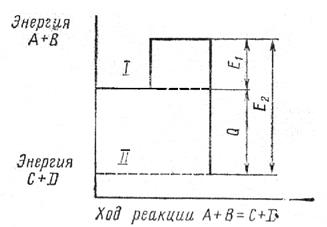 и показывает, во сколько раз увеличилась скорость реакции при увеличении температуры на 10градусов.
и показывает, во сколько раз увеличилась скорость реакции при увеличении температуры на 10градусов.
Рисунок 18.1 – Влияние энергии рассматриваемой системы молекул на горизонтальный ход реакции.
Опытными исследованиями установлено, что при повышении температуры на 10 градусов скорость гомогенных реакций увеличивается в 2-4 раза.
Уравнение вида 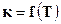 можно вывести из уравнения изохоры химической реакции (17.17)
можно вывести из уравнения изохоры химической реакции (17.17)
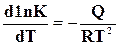 ,
,
которая выражает температурный коэффициент константы равновесия через тепловой эффект реакции. Но так как константа равновесия 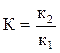 , то
, то
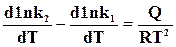 . (18.7)
. (18.7)
Рассмотрим тепловой эффект реакции как разность двух энергетических величин
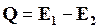 ,
,
где Е1 и Е2 относятся к прямой и обратной реакции.
На вертикальной оси (рисунок 18.1) отложена энергия рассматриваемой системы молекул на горизонтальный ход реакции. Если идет прямая экзотермическая реакция, т. е. из вещества А и В получаются вещества С и D, то общий запас энергии продуктов реакции меньше, чем исходных и система в результате переходит на более низкий энергетический уровень. Разность этих уровней равна теплоте реакцииQ. Верхний уровень определяет тот наименьший запас энергии, которым должны обладать молекулы, чтобы их столкновения могли привести к химическому взаимодействию. Разность между этим верхним уровнем и уровнем 1 представляет энергию активации прямой реакции Е1, а разность между максимальным уровнем и уровнем 2 – энергию активации обратной реакции Е2. Таким образом, в ходе реакции система должна перейти через энергетический барьер.
Уравнение (18.7) можно разложить на два, относящихся к прямой и обратной реакциям, и оно будет удовлетворено если
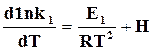 и
и 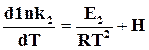 .
.
В общем случае 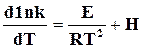 . (18.8)
. (18.8)
Это уравнение было выведено Вант-Гоффом.
На основании опытных данных можно принять Н=0, тогда уравнение (18.8) примет вид
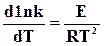 . (18.9)
. (18.9)
Интегрируя это уравнение при постоянной величине Е, получим
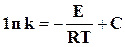 , (18.10)
, (18.10)
где С ─ константа интегрирования.
Откуда
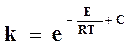 . (18.11)
. (18.11)
Это уравнение позволяет выразить зависимость константы скорости химической реакции от температуры в виде прямой в координатах 1п к, 1/Т.
Пользуясь уравнением (18.10), можно определить зависимость температурного коэффициента скорости реакции от температуры.
Для температур Т1 и Т2 получим
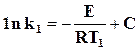 ,
, 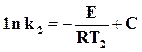 , или
, или
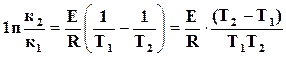 .
.
Принимая Т2=Т1+10; Т1Т2=Т2 ср и R=8,3143 кДж/(моль  град),
град),
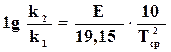 , (18.12)
, (18.12)
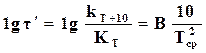 . (18.13)
. (18.13)
Откуда
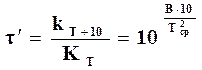 . (18.14)
. (18.14)
Полученная зависимость показывает, что 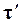 с повышением температуры уменьшается, т. е. с повышением температуры уменьшается рост константы скорости, следовательно, и рост скорости реакции. Скорость реакции при низких температурах возрастает более интенсивно, чем при высоких.
с повышением температуры уменьшается, т. е. с повышением температуры уменьшается рост константы скорости, следовательно, и рост скорости реакции. Скорость реакции при низких температурах возрастает более интенсивно, чем при высоких.
Активация
Химические реакции осуществляются в результате взаимных столкновений молекул. Скорость реакции на основании закона действующих масс зависит от концентрации реагирующих молекул, следовательно, и числа столкновений. Чем больше концентрация, тем больше будет столкновений. Однако в реакциях, протекающих с конечной скоростью, не все столкновения молекул приводят к химическому взаимодействию. Эффективными будут только те столкновения между молекулами, которые в момент столкновения обладают некоторым избытком внутренней энергии и при встрече их может выделиться энергия, необходимая для разрушения химических связей. Этот избыток энергии, необходимый для проведения данной реакции, называется энергией активации. Причина того, что топливо (бензин, керосин и т. п.) не загорается само собой, заключается в значительной энергии активации соответствующих окислительных реакций. Повышение температуры приводит к тому, что все чаще и чаще молекулы окислителя и горючего в момент столкновения имеют необходимый избыток энергии, в конце концов скорость реакции достигает большой величины – начинается горение. По теории активации к реакции могут привести только столкновения между активными молекулами, энергия которых будет больше энергии активации.
Когда число активных молекул 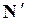 составляет относительно малую долю от их общего числа
составляет относительно малую долю от их общего числа 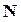 , то (на основании уравнения распределения Больцмана) отношение их равно
, то (на основании уравнения распределения Больцмана) отношение их равно
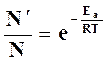 , (18.15)
, (18.15)
где Ea – некоторый минимум энергии молекул при столкновении.
В силу этого активное число столкновений, энергия которых превышает энергию активации Ea, равно
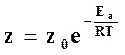 , (18.16)
, (18.16)
где z0 – полное число столкновений.
На основании уравнения (18.16) скорость химической реакции
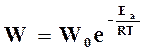 (18.17)
(18.17)
зависит как от температуры, так и от величины энергии активации.
Для бимолекулярной реакции скорость W0, соответствующая полному числу столкновений молекул равна
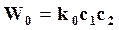 ,
,
где k0 – константа скорости по столкновению;
с1,с2 – концентрации реагентов.
Действительная скорость реакции на основании теории активации определяется по формуле
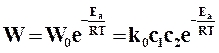 . (18.18)
. (18.18)
Обозначая величину 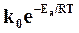 через k, получим
через k, получим
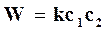 , (18.19)
, (18.19)
где k – действительная константа скорости химической реакции, которая учитывает фактор активации.
Выражение для действительной скорости реакции (18.19) имеет тот же вид, что и закон действующих масс, но учитывает фактор активации 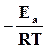 .
.
Катализ
Катализом называют явление, при котором происходит изменение скорости реакции под действием некоторых веществ (катализаторов), остающихся в результате реакции химически неизменными. Под действием катализаторов реакции могут ускоряться (положительный катализ) или замедляться (отрицательный катализ).
Отрицательный катализ играет важную роль в процессе горения. Добавление в бензин тетраэтилсвинца не способствует образованию углеводородов и подавляет детонацию.
Катализатор не влияет на химическое равновесие в системе и не может перемещать равновесие в ту или другую сторону. В задачу катализаторов входит только увеличение скорости реакции, т. е. скорейшее достижение состояния равновесия. Катализаторы всегда изменяют энергию активации, причем при положительном катализе она уменьшается. Катализатор в реакции может находиться в одной фазе с реагентом (гомогенный катализ), в разных фазах (гетерогенный катализ) или являться одним из конечных продуктов реакции (автокатализ).
Катализаторы, значительно изменяя скорости реакции и возбуждая заторможенные реакции, существенно влияют на кинетику химических реакций.
Дата добавления: 2020-07-18; просмотров: 566;











