Уравнение состояния идеальных газов
Из молекулярно-кинетической теории следует, что произведение удельного объема идеального газа на абсолютное давление, деленное на абсолютную температуру, для любого равновесного состояния есть величина постоянная:
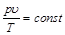 . (2.5)
. (2.5)
Постоянную величину, отнесенную к 1 кг газа, обозначают буквой R и называют газовой постоянной:
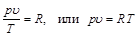 . (2.6)
. (2.6)
Уравнение (2.6) называется термическим уравнением состояния идеальных газов, или характеристическим уравнением. Уравнение состояния идеальных газов было выведено французским физиком Клапейроном в 1834 г. и поэтому названо его именем.
Для произвольного количества газа с массой 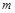 , кг, уравнение состояния имеет вид
, кг, уравнение состояния имеет вид
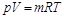 , (2.7)
, (2.7)
где р – абсолютное давление газа, н/м2; V – объем произвольного количества газа, м3; m – масса газа, кг; Т – абсолютная температура газа, °К.
Газовая постоянная R представляет собой физическую постоянную, которая для каждого газа принимает вполне определенное значение, зависящее от природы газа и не зависящее от его состояния.
Её можно выразить в виде:
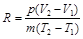 . (2.8)
. (2.8)
Числитель правой части представляет собой работу газа в процессе при постоянном давлении. Если разность температур (Т2 – Т1) равна 1°, а масса газа равна 1 кг, то газовая постоянная есть работа в джоулях 1 кг газа в процессе при постоянном давлении и при изменении температуры на 1°.
Газовая постоянная имеет следующую размерность:
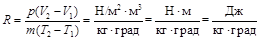 .
.
Уравнение Клапейрона в таком виде справедливо только для идеальных газов. Однако это уравнение с достаточной для практики точностью можно применять и для реальных газов, имеющих низкое давление и высокую температуру.
Дата добавления: 2020-07-18; просмотров: 734;











