Основные законы идеальных газов
Идеальными газами называют такие, которые полностью подчиняются законам Бойля-Мариотта и Гей-Люссака. В идеальных газах отсутствуют силы взаимного притяжения и отталкивания между молекулами, а объем самих молекул пренебрежимо мал по сравнению с объемом газа.
Все реальные газы при высоких температурах и малых давлениях почти полностью подходят под понятие «идеальный газ» и практически по свойствам не отличаются от него. Состояние идеального газа – это предельное состояние реального газа, когда давление стремится к нулю (р → 0).
Закон Бойля-Мариотта устанавливает зависимость между удельным объемом и абсолютным давлением идеального газа в процессе при постоянной температуре.
Закон Бойля-Мариотта гласит: при постоянной температуре объем, занимаемый идеальным газом, изменяется обратно пропорционально его давлению:
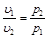 . (2.1)
. (2.1)
или при постоянной температуре произведение удельного объема на давление есть величина постоянная:
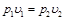 ,
, 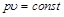 . (2.2)
. (2.2)
Закон Гей-Люссака устанавливает зависимость между удельным объемом и абсолютной температурой при постоянном давлении.
Закон Гей-Люссака гласит: при постоянном давлении объемы одного и того же количества идеального газа изменяются прямо пропорционально абсолютным температурам:
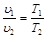 . (2.3)
. (2.3)
Дата добавления: 2020-07-18; просмотров: 706;











