Особенности термохимических уравнений.
Тепловые эффекты химических реакций
Тепловой эффект реакции -количество теплоты, которое выделяется или поглощается системой в результате протекания химической реакции. Это может быть DН (Р,Т = const) или DU (V,T = const).
Если в результате реакции теплота выделяется, т.е. энтальпия системы понижается (DН < 0), то реакция называется экзотермической.
Реакции, сопровождающиеся поглощением теплоты, т.е. с повышением энтальпии системы (DН > 0),называются эндотермическими.
Как и другие функции состояния, энтальпия зависит от количества вещества, поэтому ее велечену (DН) обычно относят к 1 моль вещества и выражают в кДж/моль.
Обычно функции системы определяют при стандартных условиях, в которые, кроме параметров стандартного состояния, входит стандартная температура T = 298,15 К (25°C). Часто температуру указывают в виде нижнего индекса ( 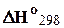 ).
).
Термохимические уравнения
Термохимические уравнения реакций - уравнения, в которых указан тепловой эффект, условия реакций и агрегатные состояния веществ. Обычно в качестве теплового эффекта указывается энтальпия реакции. Например,
C(графит) + O2 (газ) = CO2 (газ) , DН0298 = -396 кДж.
Тепловой эффект можно записать в уравнении реакции:
C(графит) + O2 (газ) = CO2 (газ) + 396 кДж.
В химической термодинамике первая форма записи употребляется чаще.
Особенности термохимических уравнений.
1.Тепловой эффект зависит от массы реагирующего вещества, поэ-
тому его обычно рассчитывают на один моль вещества. В связи с этим в термохимических уравнениях можно использовать дробные коэффициенты. Например, для случая образования одного моля хлороводорода термохимическое уравнение записывается так:
½H2 + ½Cl2 = HCl, DH0298 = -92 кДж
или Н2 + Cl2 = 2HСl, DH0298 = -184 кДж.
2. Тепловые эффекты зависят от агрегатного состояния реагентов; оно указывается в термохимических уравнениях индексами: ж - жидкое, г - газообразное, т - твердое или к – кристаллическое, р – растворенное.
Например:H2 + ½ O2 = H2О(ж), DН0298 = -285,8 кДж.
H2 + ½ О2 = H2О(г) , DН0298 = -241,8 кДж.
3.С термохимическими уравнениями можно производить алгебраические действия (их можно складывать, вычитать, умножать на любые коэффициенты вместе с тепловым эффектом).
Термохимические уравнения более полно, чем обычные, отражают происходящие при реакции изменения - они показывают не только качественный и количественный состав реагентов и продуктов, но и количественные превращения энергии, которыми данная реакция сопровождается.
Дата добавления: 2016-07-05; просмотров: 9406;











