Валентной оболочки атома (ОЭПВО)
Метод отталкивания электронных пар
Метод ВС лежит в основе определения углов между связями и их искажений под влиянием несвязывающих электронных пар. При этом исходят из того, что имеет место отталкивание электронных пар валентной оболочки (ОЭПВО).
Физические основы метода ОЭПВО, предложенного Гиллеспи и Найхолмом, определяются принципом Паули: с учетом того, что атомная орбиталь занимает определенную область пространства, можно утверждать, что в этой области может находиться только одна электронная пара, другие будут выталкиваться из этой области.
Таким образом, главное положение метода ОЭПВО состоит в том, что электронные пары валентной оболочки атома(в молекуле) взаимно отталкиваются и располагаются вокруг атома таким образом(под такими углами), чтобы это отталкивание было минимальным.
Обозначим молекулу (или ее фрагмент) АВn , где А - центральный атом, В - боковой атом (лиганд), n - число атомов В вокруг А. Электронные пары вокруг атома А могут быть связывающими (присоединяют атом В) и несвязывающими или неподеленными (обозначим их Х и Е, соответственно). Тогда электронные пары атома А в молекуле АВn (с учетом несвязывающих пар) можно обозначить как АХnEm.При этомобщее число электронных пар равно n+m. В формуле учитываются только те электронные пары, которые находятся в s - положении к атому А, то есть их электронные плотности направлены по оси связи с атомами В; все Е-пары также находятся в s-положении. В методе ОЭПВО с учётом гибридизации принимают, что все электронные пары занимают примерно одинаковое пространство. Для простоты считают, что они представляют собой сферы одинакового радиуса. Очевидно, что если размеры всех электронных пар вокруг атома А одинаковы, то они образуют правильные фигуры.
Метод ОЭПВО определяет изменения форм молекул и искажения углов между связями по сравнению с идеальными за счет неподеленных электронных пар и кратных связей, а также взаимное расположение неравноценных атомов и электронных пар. Для того чтобы воспользоваться этим методом, нужно прежде всего определить:
1) общее число электронных пар атома А;
2) по этому числу - форму правильной фигуры, образуемой электронными облаками;
3) далее необходимо установить сколько из них связывающих, несвязывающих и кратных. Удобнее всего это можно сделать, воспользовавшись схемой ВС данной молекулы;
4) После этого можно определить геометрию молекулы.
Перечислим основные положенияметода ОЭПВО.
1. Несвязывающие электронные пары отталкивают сильнее, чем связывающие, поэтому они искажают форму молекулы. Если, например, по составу электронных пар мы имеем молекулы типа АХ3 (NO3-) и АХ2Е (NO2-), то их форма в соответствии с правилом 1 будет следующей
(рис. 3.15):
В Е
 | |||
 | |||
 Х
Х






 A
A
В В В В
АВ3 (АХ3) АВ2 (АХ2E)
Рис. 4.15.Форма молекул при гибридизации sp2
2.Так как несвязывающие электронные пары отталкиваются сильнее, то при наличии нескольких несвязывающих электронных пар они располагаются на максимальном удалении друг от друга. Например, для молекул типа АВ4 с электронными парами типа АХ4Е2 (ХеF4)
(рис. 3.16, а) будет выгодна плоскоквадратная форма (sp3d2-гибридизация), а для молекул типа АВ2 с электронными парами АХ2Е3 (например, ХеF2) - линейная (рис. 3.16, б).
В последнем случае углы между парами в экваториальной плоскости больше, чем между ней и осью (120 и 900), поэтому взаимное отталкивание Е-Е в плоскости будет меньше.
3.Чем больше электроотрицательность концевых атомов (В), тем сильнее они отталкиваются несвязывающей электронной парой, то есть углы ВАВ меньше. Например, молекулы с электронными парами типа АХ3Е (NH3 и NF3) имеют углы: Ð HNH = 107° и Ð FNF = 102°, что соответствует ЭО (Н) = 2,1 и ЭО (F) = 4.
E E
       5s 5p 5d 5s 5p 5d
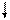 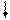 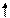 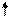           Хе*
x x x x Хе*
x x x x
 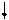 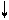 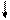 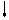     E E
2s E |
F F F F
Рис. 4.16, а. Схема ВС и структурная формула молекулы XeF4
E E Е
     5s 5p 5d 5s 5p 5d
              Хе*
x x Хе*
x x
    F F
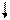 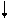 2p ½ 2p ½
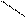  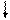  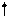   E ¾ Хе ¾ E E ¾ Хе ¾ E
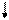 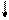     ½ E
2s F
F F
Рис. 4.16, б. Схема ВС и структурная формула
молекулы XeF2 ½ E
2s F
F F
Рис. 4.16, б. Схема ВС и структурная формула
молекулы XeF2
|
4.Кратные связи отталкивают сильнее, чем ординарные. Например, молекула ХеО3F2 (тип АВ5, тригональная бипирамида, электронные пары АХ5 + 3π) имеет три атома кислорода в плоскости (углы ОХеО = 120°), так как у них двойные связи, а молекула UO2F5-3 (тип АВ7 - пентагональная бипирамида, электронные пары АХ7 +2π) имеет линейное расположение атомов кислорода, так как углы FUF = 72°, то есть меньше 90°.
5.Искажение углов между связями под действием неподеленной электронной пары тем больше, чем больше число свободных АО на валентной оболочке атома и больше ее размеры. Например, у однотипных молекул NH3, PH3, AsH3 угол в этом ряду уменьшается с увеличением числа валентных АО (табл. 4.3). То же самое можно сказать о молекулах H2O, H2S, H2Se.
Таблица 4.3
Влияние числа валентных АО на валентный угол
| Молекула | NH3 | PH3 | AsH3 |
| Тип валент- ных элект- ронных пар | АХ3Е | АХ3Е | АХ3Е |
| Тип и число ВАО | s + 3p ; (4) | s + 3p + 5d ; (9) | s+3p+5d+7f ; (16) |
| Ð BAB (град.) |
6.В случае тригонально-бипирамидальных молекул аксиальные атомы В ближе к атому А, чем экваториальные; в случае пентагонально- бипирамидальных, наоборот, аксиальные связи короче экваториальных. Это связано с взаимным отталкиванием связывающих электронных пар (Х - Х).
Например, в молекуле PCl5 (тип АВ5 - АХ5 - пентагональная бипирамида) аксиальные атомы имеют длины связей 2,2 А°, а экваториальные - 2,04 А°. Это объясняется меньшим отталкиванием в плоскости, по сравнению с осью молекулы, как в правилах 2 и 4
(рис. 3.17).
Рассмотрим более подробно примеры определения геометрии молекул методом ОЭПВО.
Молекула ХеF4.Для построения схемы ВС берем дважды возбужденный атом Хе: ….5s2p4d2 (рис. 3.16, а). Атомы F образуют 4s - связи с неспаренными электронами Хе*. Все АО этого атома, имеющие электроны, гибридизованы - sp3d2-гибридизация с участием несвязывающих электронных пар. Если бы все шесть гибридных орбиталей были одинаковы, то они образовали бы октаэдр. Однако две из них заняты неподеленными электронными парами (АX4Е2), которые, в соответствии с правилом 2, должны располагаться на одной оси, так что атомы фтора лежат в одной плоскости с атомом Хе и образуют плоский квадрат (табл. 4.4).
Cl
      ,2,2 А° ,2,2 А°
Cl
Рис. 4.17. Структура молекулы РСl5 |
Молекула SOCl2.Берем атом серы в возбужденном состоянии, чтобы образовать три s-связи с атомами хлора (две) и кислорода (одна). Еще один неспаренный электрон идет на образование p-связи с атомом кислорода (рис. 3.18). Количество электронных пар, находящихся в s- положении, с учетом несвязывающей 3s-АО, у атома серы - четыре: АХ3Е + p-связь (sp3-гибридизация). АХ3Е дает конфигурацию тетраэдра, искаженного несвязывающей электронной парой Е : отсутствие атома на месте Едает нам вместо тетраэдра тригональную пирамиду
(табл. 3.4). Все углы будут меньше тетраэдрического (Ð109,28°), и, кроме того, можно предсказать, что угол ClSCl будет меньше, чем ClSO в соответствии с правилом 4.
Таким образом, метод ОЭПВО может предсказывать геометрию молекул. Однако она правильно делает это не во всех случаях. Наиболее приемлема эта теория к ковалентным соединениям s- и р-элементов.
Таблица 4.4.
Число локализованных электронных пар центрального
атома и пространственная конфигурация молекул АВn
| s- электронные пары атома А | Состав и форма молекулы и электронные пары | Примеры | |||
| число пар (всего) | идеальная геометрия пар | число связыв. пар (Х) | число неподе- ленных пар (Е) | ||
| линейная | линейная АВ2-АХ2 | BeCl2 | |||
| треугольная | плоский треугольник АВ3-АХ3 | BCl3 | |||
| угловая АВ2-АХ2Е | SnCl2 | ||||
| тетраэдр | тетраэдр АВ4-АХ4 | CCl4 | |||
| тригональная пирамида AB3-AX3E | NH3 | ||||
| угловая АВ2-АХ2Е2 | H2O | ||||
| тригонально –бипирами- дальная | тригональная бипирамида АВ5-АХ5 | PCl5 | |||
| неправильный тетраэдр АВ4-АХ4Е | SF4 | ||||
| Т-образная АВ3-АХ3Е2 | ClF3 | ||||
| октаэдри-ческая | октаэдр АВ6-АХ6 | SF6 | |||
| квадратная пирамида АВ5-АХ5Е | IF5 | ||||
| плоский квадрат АВ4-АХ4Е2 | XeI4,, [ICl4]- |
Полярность ковалентной связи. Электрические свойства.Атомы и молекулы содержат электрически заряженные частицы - электроны (ē) и ядра с зарядом +Z . Так как электроны быстро движутся в относительно большой области около ядра, то для определения электрических свойств атомов и молекул необходимо ввести понятие "центра тяжести" или полюса отрицательного и положительного электрического заряда. Очевидно, что в атоме они совпадают и атом неполярен. Такое положение имеет место и в некоторых молекулах: двухатомных (Э2), а также высокосимметричных многоатомных (СН4 , BF3 , SF6 и др.).
      3s 3p 3d 3s 3p 3d
          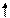 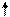  S*
Е х х х p S*
Е х х х p
3p 2p 2s
3s Е
Cl Cl S
O Cl
Рис. 4.18. Схема ВС и структурная формула молекулы SOCl2 |
Если "центр тяжести" отрицательного и положительного зарядов не совпадает, то молекула полярна и образует диполь, который характеризуется дипольным моментом, абсолютная величина которого
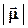 = δ l
= δ l
где  δ - заряд полюса, l - расстояние между полюсами, стрелка указывает на то, что диполь – величина векторная.
δ - заряд полюса, l - расстояние между полюсами, стрелка указывает на то, что диполь – величина векторная.
Величина mизмеряется в системе СИ в Кл·м (кулон на метр). Типичные значения можно оценить по заряду электрона (» 10-19 Кл) и длине межатомного расстояния (» 10-10 м), то есть они составляют »10-29 Кл·м. Для удобства используется специальная единица измерения дипольного момента - дебай (D):
1D = 3,33 . 10-30 Кл·м.
Для характеристики диполя, кроме его величины и направления, используют величины эффективного заряда δэфф и длину диполя l. Эти величины в той или иной степени отличаются от степени окисления и длины связи, соответственно.
Дипольные моменты молекул, содержащих полярные связи, определяются как сумма дипольных моментов связей. При этом производится векторное сложение диполей на связях (в химической литературе за положительное направление диполя принимается направление от "+" к "-"). Сумма двух диполей получается как диагональ параллелепипеда, построенного на них. Например, для угловой молекулы АВ2 :



 + А
+ А
m1 m2 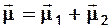 .
.
 В - m - В
В - m - В

Если диполей более 2-х, то их складывают последовательно попарно. Очевидно, что для линейных молекул АВ2 , плоских треугольных - АВ3, тетраэдрических и квадратных - АВ4 , тригонально-бипирамидальных - АВ5 , октаэдрических - АВ6 , дипольный момент равен нулю.
В таблице 4.5 приведены дипольные моменты некоторых веществ, а в таблице 4.6 - эффективные заряды (в единицах заряда электрона) на атомах в некоторых соединениях.
Эффективные заряды, характеризующие ассиметрию электронного облака, условны, так как электронное облако делокализовано и его нельзя "разделить" между ядрами; так что величины зарядов зависят от метода определения.
Таблица 4.5
Дипольные моменты некоторых молекул
| Молекула | m·1030, Кл·м | Молекула | m·1030, Кл.м | Молекула | m·1030, Кл.м |
| H2O | 5,52 | N2O | 0,51 | CsF | |
| H2O2 | 6,77 | NO | 6,48 | CsCl | 31,2 |
| HF | 5,73 | NO2 | 0,87 | CsI | 36,8 |
| HCl | 3,24 | HNO3 | 6,47 | CH3OH | 5,13 |
| HBr | 2,97 | F2O | 0,90 | C2H5OH | 5,01 |
| HI | 1,14 | BrF | 3,87 | CHCl3 | 3,03 |
| NH3 | 4,44 | O3 | 1,59 | HCOOH | 4,05 |
| PH3 | 1,74 | H2S | 3,30 | CН3COOH | 5,19 |
| AsH3 | 0,39 | NaCl | C6H5CH3 | 1,11 |
В таблице 4.6. приведены значения эффективных зарядов атомов, найденные по рентгеновским спектрам поглощения.
Отметим следующие закономерности этих величин, связанные со строением веществ. Прежде всего бросается в глаза то, что дипольные моменты большинства молекул (кроме сильно ионных) незначительно отличаются от величины 1D, а часто и существенно меньше ее. Это согласуется с табл. 3.6, из которой видно, что величины эффективных зарядов на атомах обычно меньше 1 и не достигают 2-х. Более того, явно видна закономерность: чем больше формальный заряд (степень окисления) атома, тем меньше эффективный заряд. То есть полярность связей, как правило, весьма мала и она уменьшается с увеличением степени окисления.
Таблица 4.6
Эффективные заряды атомов в некоторых соединениях
| Соединение | Атом | d |  Соединение Соединение
| Атом | d |
| HCl | Cl | -0,2 | GeBr4 | Ge | +1,1 |
| SO2Cl2 | Cl | -0,1 | ZnBr2 | Br | -0,3 |
| C2H4Cl2 | Cl | ZnBr2 | Zn | +0,5 | |
| KClO3 | Cl | +0,7 | ZnBr2 | Br | -0,25 |
| LiClO4 | Cl | +0,8 | IBr | Br | -0,1 |
| H2S | S | -0,2 | GeH4 | Ge | +0,2 |
| SO2 | S | +0,1 | GeO2 | Ge | +0,1 |
| SCl2 | S | +0,2 | K2Cr2O7 | Cr | +0,1 |
| CaSO4 | S | +0,4 | K2CrO4 | Cr | +0,2 |
| KMnO4 | Mn | +0,3 | CrCl3 | Cr | +1,3 |
| CaTiO3 | Ca | +1,5 | CrCl2 | Cr | +1,9 |
В качестве меры полярности связи или молекулы часто используют величину степени ионности (i) или ковалентности (К).
i + K = 1; 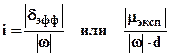 .
.
Так, если в молекуле HCl qCl = 0,2qe, а wCl = -1, то i = 0,2, т.е степень ионности равна 20 %, а степень ковалентности - 80 %.
Величина ионности связи А-В может быть оценена также по разности электроотрицательностей атомов 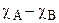 (DЭО) (табл. 4.7,
(DЭО) (табл. 4.7,
рис. 4.19).
Рисунок 4.19 приближенно выражает установленную Полингом зависимость между степенью ионности связи и разностью электроотрицательностей элементов. Из рисунка следует, что только для фторидов щелочных и щелочно-земельных металлов связь можно считать близкой к ионной.
Так как 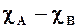 для фторидов щелочных металлов около 3, то
для фторидов щелочных металлов около 3, то
i » 90 %, что близко к чисто ионной связи.
Рис. 4.19. Зависимость степени ионности связи от разности
электроотрицательностей элементов (по Полингу)
Таблица 4.7
Зависимость степени ионности от разности
электроотрицательностей
| DЭО | i, % | DЭО | i, % | DЭО | i, % | DЭО | i, % |
| 0,1 | 0,5 | 0,9 | 1,7 | 2,4 | |||
| 0,2 | 1,0 | 1,8 | 2,5 | ||||
| 0,3 | 1,1 | 1,9 | 2,6 | ||||
| 0,4 | 1,2 | 2,0 | 2,7 | ||||
| 0,5 | 1,4 | 2,1 | 2,9 | ||||
| 0,6 | 1,5 | 2,2 | 3,1 | ||||
| 0,8 | 1,6 | 2,3 | 3,2 |
Эта зависимость нелинейна, а сами цифры весьма приближенны, как и все зависимости, связанные с электроотрицательностью элемента.
Так как величины χ и i являются важными характеристиками атомов и химических связей в соединениях, то полезно также иметь математическую формулу связи между ними:
i = 1 – exp[-0,25(χА – χВ)2] .
Эта формула не претендует на точность, как и сами величины ионности и электроотрицательности, но практически полезна при сравнении ионности химических связей.
Дата добавления: 2016-07-05; просмотров: 3262;








 Xe
Xe









 Cl 2,04 А° Cl
Cl 2,04 А° Cl


 Cl P
Cl P










 Cl
Cl









