Теория молекулярных орбиталей (MO)
В отличие от метода ВС, метод МО рассматривает образование молекул не из атомов, а из ядер атомов и электронов, которые и образуют особые состояния - молекулярные орбитали, являющиеся одноэлектронными волновыми функциями (с учетом спина на каждой МО может быть 2 электрона, как и на АО). Как и в методе ВС, в методе МО молекулярные волновые функции получают линейной комбинацией атомных орбиталей, и поэтому для обозначения метода и его названия используется аббревиатура МО - ЛКАО.
Молекулы из элементов первого периода.Для представления результатов расчета по методу МО - ЛКАО используются корреляционные диаграммы МО(рис. 3.20).
Принцип ее построения и смысл параметров ясен из рисунка: по бокам изображены АО исходных атомов с соответствующим числом электронов, а между ними - МО с теми же электронами, что были на АО. По вертикали откладывается энергия. МО заполняются электронами в соответствии с общими квантово-механическими правилами. Диаграмма называется корреляционной, так как показывает, из каких АО получаются данные МО (то есть корреляцию между АО и МО).
Легко показать, что в методе МО связь образует не обязательно электронная пара; возможно образование связи одним, тремя или большим числом электронов (рис. 4.20); главное условие - число электронов на связывающих МО должно быть больше, чем на разрыхляющих, а кратность связи - больше нуля. Кратность связи может быть дробной.
По методу МО кратность связи (к. с.) определяется по формуле:
nē на связывающих МО - nē на разрыхляющих МО
2 .
Диаграммы МО, приведенные на рисунке 3.20, показывают, что возможно существование таких частиц, как Н2+, Н2- и НеН. Кратность такой связи для молекулярного иона Н2- равна 0,5.
Такие частицы действительно обнаруживаются в газовой фазе. В то же время для молекулы Не2 к.с. = 0, и она не существует.
 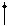 H2 H2- HеН
ssp ssp ssp H2 H2- HеН
ssp ssp ssp
 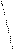 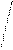  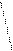        Н Н H- Н Не Н Н Н H- Н Не Н
    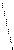 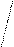    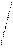 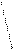 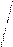   
Рис. 4.20.Диаграммы МО Н2, Н2-, НеН |
Двухатомные молекулы из элементов второго периода.У элементов 2-го периода имеется 4 валентных АО: 2s, 2px, 2py и 2pz . При этом 2s- и 2р-АО имеют большое отличие в энергии и размерах, поэтому в грубом приближении можно рассматривать взаимодействия s-s и р-р типа и не рассматривать s-р (рис. 4.21).
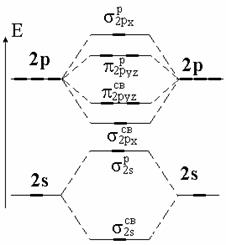
Рис. 4.21. Схема образования молекулярных орбиталей
из атомов 2-го периода
Пример 5. Сопоставить магнитные свойства и прочность связей в молекуле F2 и ионе F2+.
Решение. Диаграмма молекулярных орбиталей молекул элементов второго периода имеет следующий вид: рис. 3.21. Электронная формула валентных электронов F - 2s22p5. Следовательно, нужно разместить 14 валентных электронов, из них 8 электронов будут находиться на связывающих орбиталях (2 электрона - на s2sсв и 6 - на s2pxсв и p2pyzсв) и 6 электронов - на разрыхляющих (2 электрона на s2sр и 4 электрона - на p p2pyz) (рис. 3.22, а).
В молекуле F2 кратность равна: (8 - 6) / 2 = 1. Молекула F2 диамагнитна – все электроны спаренные. Ион F2+ получается, если молекула F2 теряет один электрон (с самой высокой занятой МО -pр2ру или pp2рz), и тогда кратность связи в F2+ равна
(8 - 5) / 2 = 1,5. Ион F2+ - парамагнитен (есть один неспаренный электрон). Так как кратность связи в ионе F2+ больше, чем в молекуле F2, следовательно, ион F2+ прочнее молекулы F2.
Метод МО правильнее, чем ВС, предсказывает магнитные свойства молекул. Например, экспериментально установлено, что молекулы О2 парамагнитны и содержат по 2 неспаренных электрона каждая. Из простой диаграммы ВС следует противоположный вывод - все электроны спарены. Диаграмма МО, с учетом заполнения орбиталей по правилу Гунда, дает правильный результат: имеется 2 неспаренных электрона на p-МО, кратность связи равна 2 (рис. 4.22, б).
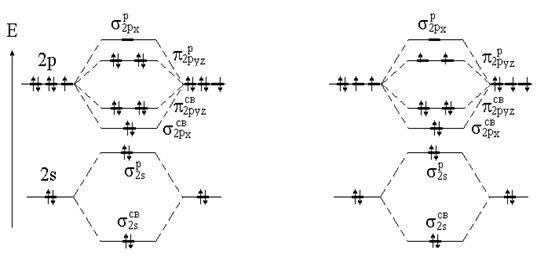
А б
Рис. 4.22. Диаграмма МО для молекул фтора (а) и кислорода (б)
Дата добавления: 2016-07-05; просмотров: 2754;





 ssсв ssсв ssсв
ssсв ssсв ssсв









