Двухатомные гетероядерные молекулы первого и второго периодов.
Диаграммы МО гетероядерных молекул отличаются от диаграмм МО изоэлектронных им гомоядерных молекул тем, что АО исходных атомов имеют разную энергию. Разница энергий DЕи является мерой ионности связи. Например, для молекулы СО (рис. 4.23) 2р- и 2s-АО
кислорода смещены вниз по энергии по сравнению с этими АО для углерода. Соответственно, sрхсв , pyсв и pzсв расположены ближе по энергии к 2р-АО кислорода, что означает смещение электронной плотности на этих МО к кислороду.
МО СО
 sxр sxр
    АО АО АО АО
       С О
2р
pyр pzр С О
2р
pyр pzр
         2р
DЕ 2р
DЕ
sxсв
pyсв pzсв
к.с. = 3;
Рис. 4.23.Диаграмма МО молекулы СО |
Следует отметить, что диаграммы МО для молекул СО и N2 весьма похожи (одинаковое чис-
ло электронов). В соот-
ветствии с этим и молеку-
лы похожи по своим свойствам. Это относится не только к кратности связей, их длине (  ) и энергии (Есв), но и к та-
) и энергии (Есв), но и к та-
ким свойствам, как темпе-
ратуры конденсации (-190 и -91°С) и кристаллизации (-210 и -204°С) соответствующих газов; оба газа плохо растворя-
ются в воде; похожи и их электронные спектры (молекулы, имеющие сходное электронное
строение, называют также
изостерами).
Метод МО дает сразу делокализованные связи в сложных молекулах. Рассмотрим, например, молекулу ВеН2. В простейшем варианте метода ВС она имеет 2 различные s-связи: 2s-1s и 2р-1s (рис. 3.24).
2s 2p

1s 1s
Форма локализованных s-связей
Рис. 4.24. Схема ВС молекулы ВеН2 с локализованными s-вязями
Они выравниваются с помощью процедуры гибридизации 2s ± 2р ® 2sр. В методе МО образуются 2 разные s-МО: s2s св и s2рсв. Но каждая из них равномерно охватывает все 3 атома, так что электронные плотности на обоих промежутках Ве-Н одинаковы (рис. 3.25). Таким образом, химическая связь в молекуле ВеН2 осуществляется за счет двух электронных пар, двигающихся в трехцентровых s2sсв- и s2рсв-орбиталях.
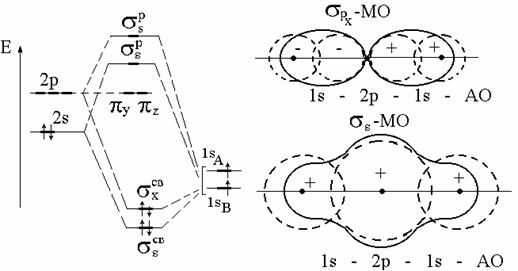
Рис. 4.25. Энергетическая диаграмма и формы МО молекулы ВеН2
Каждая из двух электронных пар в равной степени принадлежит обоим атомам водорода, то есть по 1/2 на каждую связь. Поэтому можно считать порядок связи Ве-Н равным 1 и строение этой молекулы выразить структурной формулой Н-Ве-Н ,которая показывает, что связи Ве-Н равноценны, то есть имеют одинаковую длину и энергию.
Дата добавления: 2016-07-05; просмотров: 1778;








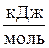 ;
;









