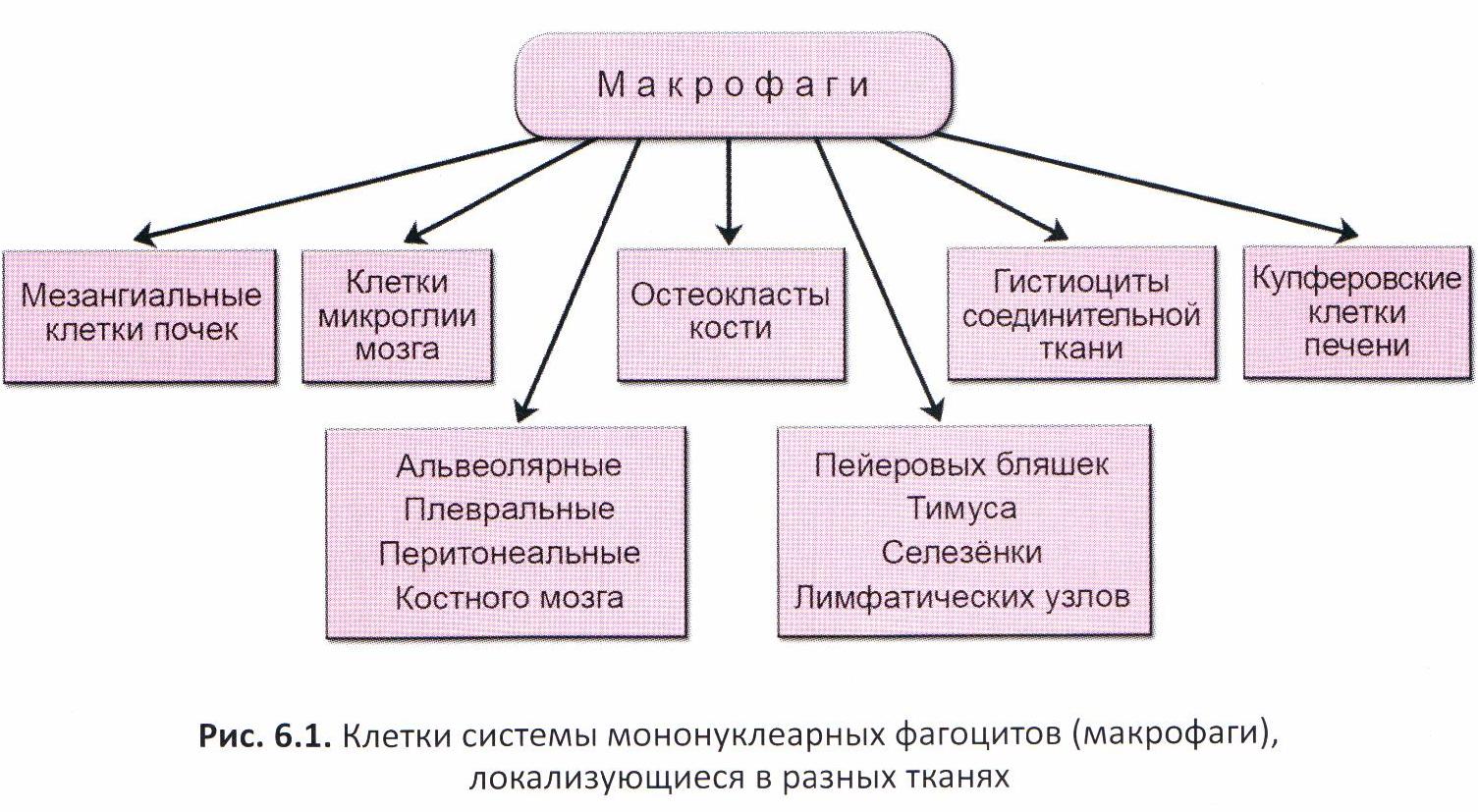
Клетки системы мононуклеарных фагоцитов
Представлены костномозговыми предшественниками фагоцитов, моноцитами и тканевыми макрофагами.
В зависимости от локализации имеют соответствующее название, строение и функции одинаковы.
Функции:
1. Ключевые эффекторные клетки врожденного иммунитета (наряду с NK-Л и нейтрофилами).
2. Являясь одной из форм АПК, участвуют в формировании адаптивного иммунитета (наряду с дендритными клетками и В-Л).
3. Активируемые в процессе эндоцитоза чужеродных частиц секретируют растворимые продукты различной активности: лизоцим, протеазы, коллагеназы, эластазы, активатор плазминогена, цитокины, компоненты системы комплемента, простаноиды, фибронектин, факторы свертывания крови и др.
4. Некоторые – хемоаттрактанты, рекрутируют в очаг воспаления разные гистологические типы клеток, в основном миелоидного ряда.
5. Некоторые – микробицидное действие благодаря продуктам лизосом, секретируемых при экзоцитозе.
6. Некоторые их продукты обладают ранозаживляющими свойствами.
7. Эндоцитоз отживших и разрушенных клеток собственного организма.
8. Ряд их цитокинов способствует межклеточным взаимодействиям, проявляет воспалительные свойства, развивает регуляторную активность по отношению к клеткам системы иммунитета, способствует деструкции опухолей.
Моноциты (3-11% в крови) – образуются в костном мозгу под влиянием цитокинов промоноциты монобласты миелоидная стволовая клетка, в течение суток выселяются в кровоток, где находится до 2-х сут. (12-32 ч.). Подразделяются на 2 группы: циркулирующие и пристеночные – тесно контактирующие с клетками эндотелия и готовые к межэндотелиальной миграции в ткани, где превращаются в макрофаги. Могут дифференцироваться в миелоидные дендритные клетки. В тканях находятся до 30 сут. В лизосомах моноцитов содержится большое количество ферментов (лизоцим, лактоферрин, пептиды-антибиотики, кислые гидролазы – протеазы, нуклеазы и др.). На мембране экспрессируется множество молекулярных структур, включающих антигены гистосовместимости, рецепторы для компонентов системы комплемента, цитокинов, хемокинов и др.Защитные функции– рекрутируют в воспалительный очаг клетки воспаления, эффекторные функции к генетически чужеродным клеткам-мишеням (антителозависимая клеточная цитотоксичность), секретируют бактерицидные продукты, поглощают антиген и обеспечивают его фрагментацию (1 моноцит фагоцитирует около 100 бактерий (нейтрофил – 5-25)), предшественник макрофагов
Макрофаги – первыми встречаются с антигеном в поврежденной им ткани (совместно с нейтрофилами). Продукция цитокинов вследствие их активации является важным индуцирующим стимулом для вовлечения в формирование воспалительного очага нейтрофилов и др. лейкоцитов, включая моноцитов, образующих макрофагов новой волны. А также является основой для создания количественной массы клеток, необходимой для полной фрагментации антигена и завершения воспаления. Долгоживущие клетки – живут в тканях месяцы – годы.
Направленная миграция макрофагов (хемотаксис) к антигену и в очаг формирующегося воспаления обеспечивается под влиянием хемотаксинов или хемоаттрактантов. Свойствами хемоаттрактантов обладают хемотаксические молекулы микробов; цитотаксины, продуцируемые фагоцитами и др. кл. под влиянием бактериальных эндотоксинов; продукты деструкции тканей; секреты активированных клеток в воспалительном очаге – интерлейкин, хемокины, гистамин, лейкотриен и др.; компоненты, образуемые при активации системы комплемента и др. Ограничивают хемотаксис – ряд бактериальных продуктов, некоторые гормоны, a2-макроглобулин и др. На мембране имеются соответствующие рецепторные структуры, взаимодействие лигандов с которыми формирует специфический сигнал, прохождение которого по внутриклеточным сигнальным путям определяет направление функционирования фагоцита, в частности направленное движение. Его основа – реакция белков цитоскелета (актина), изменение формы клетки из округлой в треугольную с псевдоподиями.
Движение клеток в отсутствие градиента хемоаттрактантов называют спонтанной миграцией фагоцитов, ненаправленное усиление подвижности клеток под влиянием химических веществ – хемокинезом.
Индуцированный хемоаттрактантами хемотаксис макрофагов сопровождается их взаимодействием с антигеном, его поглощением и фрагментацией, этот процесс включает этапы взаимодействия рецепторов с лигандами.
Рецепторы, обеспечивающие распознавание АГ на первичных стадиях доимунного воспаления называются рецепторы PRR (Pattern Recognition Receptors), т.е. распознающие общий образ АГ или его недетализированный тип.
Структура общего образа инфекционного АГ обозначается в качестве молекулярной мозаики патогена – PAMP (Pathogen-Associated Molecular Pattern) – это структуры бактерий, вирусов, простейших, грибов, компоненты в норме отсутствующие в организме.
Рецепторы PRR по функциональной активности подразделяют на распознающие PAMP антигена и способствующие его эндоцитозу и фрагментированию и сигнальные – активирующие гены цитокинов для формирования иммунного ответа.
Другой тип рецепторов для молекул эндогенного происхождения: к IgG и IgE, к компонентам комплемента, ряду цитокинов, белков адгезии и др. Важную роль играют расположенные на их мембране антигены гистосовместимости классов I и II, имеющие большое значение на поздних стадиях этапа доиммунного воспаления.
Фагоцитоз, опосредованный через рецепторы к молекулам сывороточного происхождения, опсонизирующим микробную клетку – С-реактивный белок, белки системы комплемента, пентраксины, фиколины, коллектины, антитела IgG и др. называется непрямым, а опосредованный через молекулярные структуры РАМР – прямым.
Группа РАМР-рецепторов включает семейства:
1. Toll-подобные рецепторы (11 классов) – TLR (Toll-Like Receptors) – на поверхности клетки, распознают разнообразные компоненты патогенных микроорганизмов;
2. Рецепторы, связывающие участки нуклеотидов, обогащенные лейциновыми повторами (20+14) – NBS-LRR (Nucleotide-Binding Site – Leucine-Rich Receptors) – внутриклеточные, распознают компоненты микроорганизмов, попавших в цитоплазму клетки.;
3. Рецепторы «для уборки мусора» (6)- SR (Scavenger Receptors) – на клеточной поверхности, связывают модифицированные липопротеины низкой плотности, подвергаются эндоцитозу (отличие от др. рецепторов) и фрагментации.
4. Полилектиновые рецепторы – MLRF (Multilectin Receptors Family) – распознают углеводы и связывают по типу белок-углевод и др.
Гранулоциты
Их цитоплазма содержит гранулы. В зависимости от окрашивания гранул подразделяются на базофилы (окрашиваются основными красителями), эозинофилы (кислыми красителями), нейтрофилы (не окрашиваются). Образуются в костном мозгу из общего миелоидного предшественника, проходят несколько стадий созревания и на последней стадии дифференцировки выселяются в кровь. После непродолжительной циркуляции в крови (часы) поступают в ткани, где погибают по механизму апоптоза.
1) Нейтрофилы (нейтрофильные гранулоциты) –полиморфноядерные лейкоциты, подразделяют на юные (метамиелоциты, бобовидное ядро), палочкоядерные (подковообразное ядро) и сегментоядерные (ядро из 2-5 сегментов). Созревают в костном мозгу от 7 до 14 дн. со скоростью 8 млн кл./ч. под влиянием цитокинов.
В процессе созревания в цитоплазме формируется 2 типа гранул, содержащих более 20 протеолитических ферментов и др.:
1. Первичные или азурофильные (на стадии промиелоцита);
2. Вторичные или специфические (миелоцит) – 80%.
Выселяются из костного мозга в течение суток после созревания, самая многочисленная популяция (60-75% - плотоядные, 50% - лошади, 20-30% - жвачные, 40-70% - человек).
В крови образуют 2 пула – циркулирующий ( в крови 6-14 ч) и маргинальный или пристеночный (в ЖКТ, печени, легких, до 7 дн.), гибель апоптозом и фагоцитируются макрофагами.
Под влиянием хемотаксических стимулов (продукты микробов, поврежденные ткани и др.) первыми мигрируют в очаг воспаления (жар, покраснение, припухлость, боль, снижение функции), поглощают и переваривают АГ.
2) Эозинофилы или эозинофильные гранулоциты – включает этапы юных, палочкоядерных, сегментоядерных, зрелые имеют удлиненные вторичные гранулы (ферменты), первичные гранулы содержат ферменты, разрушающие гистамин, анафилатоксин и др. В крови - 0,5-5%; в слизистых бронхов, ЖКТ, половых органов. Количество возрастает при аллергиях, гельминтозах, паразитарных заболеваниях. Живут в крови от 30 мин до 12 ч., в тканях – 8-12 сут. Экспрессируют антигены гистосовместимости класса I, рецепторы для компонентов комплемента, для IgG, IgE, маркерный АГ, отличающий эозинофилы и нейтрофилы. Способны обезвреживать токсины, фагоцитируют гранулы гистамина и тормозят его выброс базофилами и тучными клетками, последними мигрируют в очаг воспаления и способствуют его ликвидации, противопаразитарная защита – секретируют ферменты, разрушающие структуры гельминтов и грибков.
3) Базофилы или базофильные гранулоциты – 0,5-1%, живут в тканях несколько суток, в крови – 4-8 ч. Секретируют цитокины и экспрессируют рецепторы. Первичные гранулы содержат гидролитические ферменты, вторичные – гистамин, гепарин, анафилаксин, факторы хемотаксиса нейтрофилов и эозинофилов. Под влиянием аллергена происходит дегрануляция и высвобождение этих веществ. В результате формируется комплекс защитных реакций, обусловленных сокращением гладкой мускулатуры, бронхоспазмом, расширением сосудов, повышением сосудистой проницаемости, привлечением в зону др. типов клеток – мононуклеарных, нейтрофилов, эозинофилов, стимуляцией агрегации тромбоцитов и др.
Тучные клетки
- являются резидентными клетками соединительной ткани, содержатся преимущественно в коже, органах дыхания и ЖКТ. В свободном состоянии – в слизистых, просвете бронхов, соединительной ткани по ходу нервных волокон и кровеносных сосудов. По локализации и гранулярным продуктам подразделяют на соединительнотканные и слизистые (или атипичные). Содержат много крупных метахроматических гранул, представляющих собой модифицированные лизосомы. Синтезируют факторы хемотаксиса нейтрофилов и эозинофилов, цитокины, фактор агрегации тромбоцитов, медиаторы повреждения и репарации тканей – химаза, триптаза, гиалуроновая кислота, гистамин, серотонин, гепарин, лейкотриены, простогландины и др. При активации происходит денатурация, продукты гранул высвобождаются во внеклеточное пространство и проявляют различные эффекты, в зависимости от потребности – сокращение гладкой мускулатуры, хемотаксическое, ферментативное или вазоактивное действие, стимуляция периферических нервных окончаний и др. По функциям – аналоги базофилов, но от разных предшественников.
Тромбоциты
- безъядерные постклеточные структуры зрелых мегакариоцитов, фрагменты их цитоплазмы. Мегакариобласты Þ промегакариоциты Þ мегакариоциты - живут 10 сут. и каждый продуцирует 2-5 тыс. тромбоцитов - живут 8-11 сут., экспрессируют рецепторы, имеют изоантигены групп крови резус и А, В, 0.
2 типа гранул, включающих факторы свертывания крови: 1) a-гранулы – ферменты (глюкуронидаза, фосфатаза, тромбокиназа и др.) и 2) плотные тельца – соединения (фибриноген, серотонин, АДФ, АТФ и др.). При нарушении стенки сосудаиз поврежденной ткани секретируется внешний фактор свертывания крови, определяющий адгезию тромбоцитов к поврежденной поверхности. При этом из тромбоцита высвобождаются плотные гранулы, содержащие внутренний фактор свертывания крови. Он индуцирует агрегацию тромбоцитов, тромбирующих сосуд.
Оба фактора активируют протромбин (белок плазмы) в тромбин под влиянием кофактора тканевого тромбопластина, активирующегося при повреждении тканей. Под влиянием тромбина фибриноген образует нити фибрина, обеспечивающие коагуляцию (свертывание) крови. Прикрепляясь к нитям фибрина, тромбоциты содействуют уплотнению сгустка, который уменьшается в размерах за счет втягивания нитей фибрина внутрь тромба. Тромбирование сосудов предотвращает и расселение микробов с током крови по организму.
Активированные тромбоциты высвобождают вещества, участвующие в воспалении (гидролазы, вазоактивные липиды и др.).
Считается, что оказывают цитотоксическое действие на трематоды.
Клетки эндотелия
В покоящейся ткани клетки эндотелия мелких сосудов регулируют процессы физиологической экставазации макромолекул и лейкоцитов из кровеносных сосудов в ткани, поддерживающих генетическое постоянство внутренней среды организма.
Под влиянием микроорганизмов, продуктов нарушенной ткани или цитокинов, продуцируемых мононуклеарными фагоцитами, гранулоцитами, тучными клетками, тромбоцитами, лимфоцитами, клетки плоского эндотелия активизируются и трансформируются в клетки высокого (кубического) эндотелия, выстилающего посткапилярные венулы.
Это один из важнейших начальных этапов формирующегося воспаления, существенно влияющий на последующие стадии. Он приводит к развитию процессов, привлекающих клетки иммунной системы в формирующийся очаг воспаления: продукции цитокинов и прежде всего a-хемокинов (нейтрофилов) и b-хемокинов (мноцитов и лимфоцитов), являющихся основными хемоаттрактантами, активирующими эмиграцию лейкоцитов из крови в ткань. Значительно повышается экспрессия молекул адгезии на эндотелиальных клетках и лейкоцитах, последние задерживаются и фиксируются на поверхности первых, что способствует диапедезу лейкоцитов через сосудистую стенку.
Другие процессы при активации – повышение апоптотической устойчивости клеток, бактерицидной активности эндотелия (NO), активации тромбоцитов, синтеза простогландинов, боли, расширения сосудов, усиление их проницаемости, подавления агрегации тромбоцитов.
Лекция 6
1. Антигены
1. АГ и условия, определяющие их иммуногенность
Антигенамиилииммуногенаминазывают вещества биологической или химической природы, структурно отличающиеся от молекул собственного организма, распознаваемые системой иммунитета как генетически чужеродные и способные при попадании в организм вызвать специфический иммунный ответ, направленный на их разрушение и элиминацию.
АГ подразделяют на 3 основные группы:
1. Экзогенные
2. Эндогенные – аутоантигены
3. Аллергены
АГ имеют структурные отличия, определяющие их специфичность.
Условия индукции иммунного ответа зависят от структуры АГ и генотипа иммунизируемой особи.
› АГ являются белки, полипептиды, полисахариды, липополисахариды, липопротеины, отдельные синтетические высокомолекулярные соединения, вирусы, бактерии, простейшие, грибы, гельминты, разные типы клеток и их компоненты и т.д.
› Формирование иммунного ответа определяется поступлением АГ и его распознаванием рецепторным аппаратом клетки. Распознается не вся молекула АГ, а небольшие его химические группировки – эпитопы или антигенные детерминанты.
› В организме образуется столько типов АТ, сколько имеется в АГ детерминант разной структуры, доступных распознаванию антигенраспознающими рецепторами лимфоидных клеток, т.е. к каждому эпитопу образуется комплементарное ему АТ, специфически взаимодействующее только с данным эпитопом или одинакового с ним строения.
› Объем эпитопа - 2-3 нм3, длина - 2,4 нм (7-15 аминокислотных или 6 моносахаридных остатков), молекулярная масса 0,6-1,0 кДж.
› Эти молекулы определяют специфичность АГ– линейного или глобулярного, отличия от др. АГ, взаимодействуют с антигенраспознающими рецепторами лимфоцитов и с АТ против конкретного АГ.
› Молекулярные структуры меньшей величины антигенными свойствами не обладают.
› Количество эпитопов в разных АГ различается: яичный альбумин – 5, дифтерийный токсин – 8, вирус тобачной мозаики – 650, лимфоцит – 1000.
› Число эпитопов, связавших максимальное количество молекул АТ, характеризует валентность антигена.
› Обычно валентность увеличивается с увеличением молекулярной массы АГ. Но не является точным критерием количества эпитоаов. Количество эпитопов в АГ может быть больше за счет участков внутри глобулы, недоступных для АТ.
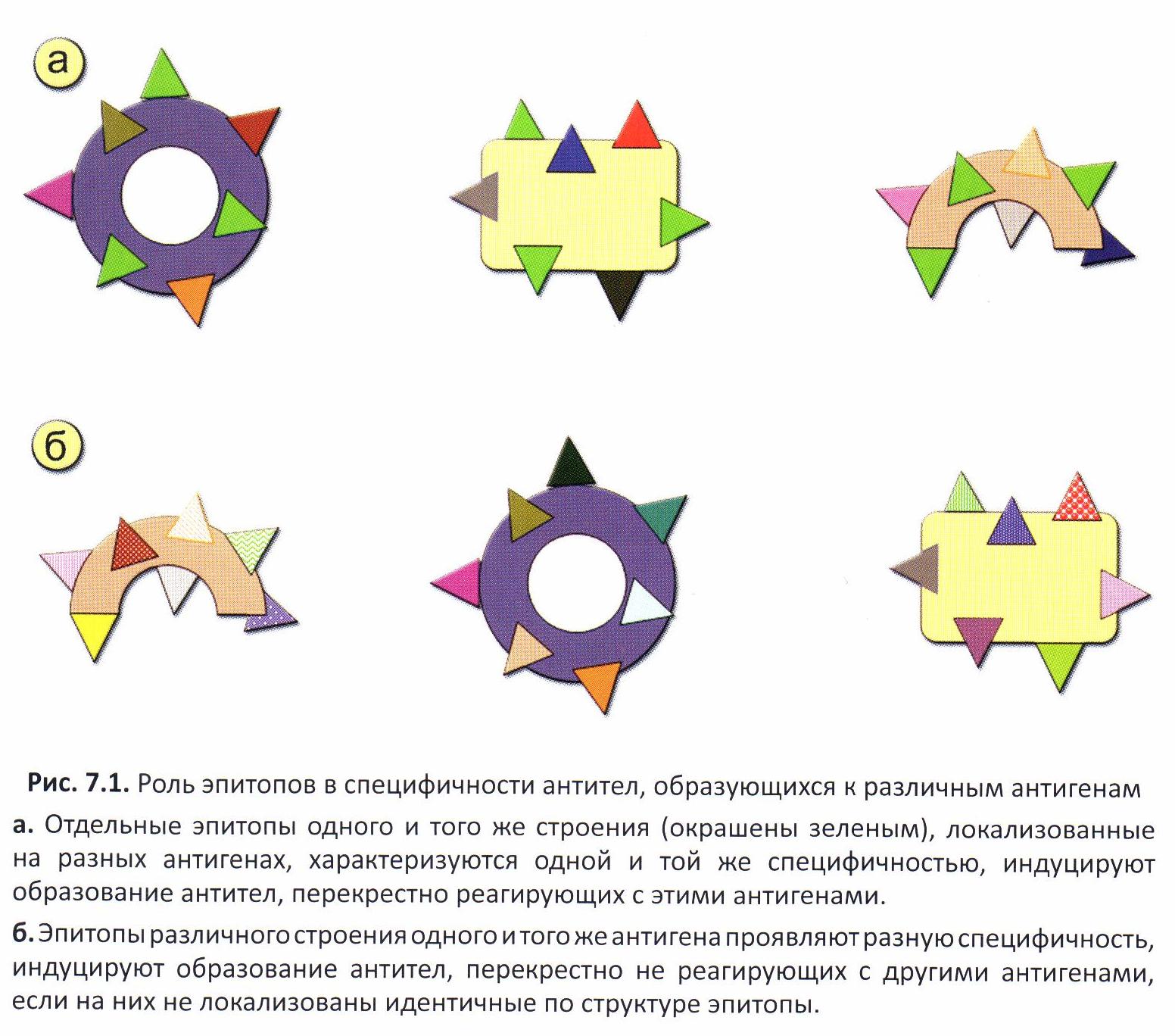
› Поэтому АГ характеризуются высокой степенью специфичности. Исключение составляют перекрестно-реагирующие АГ, включающие эпитопы сходного строения (пр. реакция эритроцитов барана с антисывороткой кроликов, иммунизированных АГ органов морских свинок (печени, почек и др.) – форсмановский АГ).
› Противоположный процесс – эффект конкуренции антигенов, т.е отсутствие иммунологической реакции или ее заметное снижение на АГ или антигенную детерминанту при введении в организм другого АГ или детерминанты.
› Различают 3 формы конкуренции АГ:
› 1. Внутримолекулярная – конкурирующие АГ или детерминанты локализуются на одной молекуле АГ.
› 2. Межмолекулярная – конкурирующие эпитопы АГ локализуются на разных молекулах.
› 3. Последовательная – разновидность межмолекулярной, возникает при последовательной иммунизации разными АГ.
› АГ, индуцирующий подавление иммунного ответа к др. АГ, называется доминантным АГ.
› Иммунодоминантные эпитопы вызывают наибольшую стимуляцию иммунного ответа.
› Способность АГ создавать иммунитет характеризует их иммуногенность.
› Антигенность АГ – качественная способность вызывать иммунный ответ той или иной величины.
› Группы эпитопов, определяющие иммунологическую специфичность АГ, называют детерминантными группами.
› АГ, вызывающие развитие иммунного ответа и реагирующие с образованными против них АТ, называют полными АГ.
› АГ не способные на иммунный ответ и выработку АТ, но способные к реакции с АТ, называют неполными АГ или гаптенами (липиды, нуклеиновые кислоты, углеводы, лекарственные вещества и др.).
› Иммунный ответ против гаптенов развивается только при их соединении с высокомолекулярными АГ.
› Соединение белка с гаптеном или др. АГ, формирующее новую иммунологическую специфичность, называется конъюгированным АГ.
› Белок в составе конъюгированного АГ называется носителем.
› На конъюгированный АГ вырабатываютсяАТ 3 типов:
› 1) против носителя (распознают Т-Л),
› 2) против гаптена (В-Л),
› 3) против трансформированного участка молекулы в результате конъюгации носителя и гаптена (Т-Л).
› Антигены собственного организма способны вызвать иммунный ответ: при прорыве барьерных образований (пр. гематоэнцефалического) и иммунизации АГ забарьерных тканей или в результате мутаций или изменения структуры в результате различных воздействий (пр. денатурация белка), когда они становятся чужеродными для организма, при этом развиваются аутоиммунные поражения.
› Антигенность белков возрастает по мере увеличения филогенетических различий между донором АГ и реципиентом, а также зависит от функций (свойств), молекулярной массы, жесткости структуры, изометрии молекулы, дозы АГ и др.
› В зависимости от участия Т-лимфоцитов в процессе индукции иммунного ответа, в частности продукции АТ, АГ подразделяют на тимусзависимые и тимуснезависимые.
› Последние подразделяют на 2 типа: тимуснезависимые АГ класса I – активируют зрелые и незрелые В-Ли тимуснезависимые АГ класса II – активируют только зрелые В-Л.
› Единой классификации АГ нет. По растворимости – растворимые и корпускулярные (нерастворимые); по происхождению – лейкоцитарные, лимфоцитарные, тромбоцитарные, эритроцитарные, клеточные, сывороточные, микробные, бактериальные, раково-эмбриональные и т.д.; по зависимости от применяемых процедур – трансплантационные, по зависимости от кодирующих генетических структур – АГ главного комплекса гистосовместимости и т.д.
› Аллергены подразделяют на микробные, инсектные, бытовые, производственные, пищевые и т.д. Микробные – на бактериальные, вирусные и т.д.
› Выделенные из разных органов – органоспецифические, тканей – тканеспецифические, разные стадии развития в эмбриогенезе – стадиоспецифические; разных видов животных – видоспецифические; особи и группы в пределах вида – изоантигены, группоспецифические; отличающие компоненты разных микробов одного вида – типоспецифические.
Искусственные или синтетические – АГ, полученные в результате химического синтеза структур по принципу природных или неприродных аналогов.


Дата добавления: 2016-07-05; просмотров: 3778;











