Окисление жирных кислот
Биологическое окисление жирных кислот можно сопоставить со сгоранием углеводородов: как в одном, так и в другом случае наблюдается наибольший выход свободной энергии. При биологическом b-окислении углеводородной части жирных кислот образуются двууглеродные активированные компоненты, доокисляющиеся в ЦТК, и большое количество восстановительных эквивалентов, которые приводят к синтезу АТР в дыхательной цепи. Большинство аэробных клеток способно к полному окислению жирных кислот до углекислого газа и воды.
Источником жирных кислот служат экзогенные или эндогенные липиды. Последние чаще всего представлены триацилглицеридами, которые откладываются в клетках в качестве резервного источника энергии и углерода. Кроме этого, клетки используют и полярные липиды мембран, метаболическое обновление которых происходит постоянно. Липиды расщепляются с помощью специфических ферментов (липазы) до глицерола и свободных жирных кислот.
b-окисление жирных кислот. Этот основной процесс окисления жирных кислот осуществляется у эукариот в митохондриях. Переносу жирных кислот через мембраны митохондрий способствует карнитин(g-триметиламино-b-оксибутират), который связывает молекулу жирной кислоты особым образом, в результате чего положительный (на атоме азота) и отрицательный (на атоме кислорода карбоксильной группы) заряды оказываются сближенными и нейтрализуют друг друга.
После транспорта в матрикс митохондрий жирные кислоты подвергаются активации с помощью СоА в АТР-зависимой реакции, которую катализирует ацетат-тиокиназа (рис. 9.1). Затем ацил-СоА-производное окисляется с участием ацил-дегидрогеназы. В клетке существует несколько разных ацилдегидрогеназ, специфичных к СоА-производным жирных кислот с разной длиной углеводородной цепи. Все эти ферменты используют FAD в качестве простетической группы. Образующийся в реакции FADH2 в составе ацилдегидрогеназы окисляется другим флавопротеидом, переносящим электроны к дыхательной цепи в составе митохондриальной мембраны.
Продукт окисления — еноил-СоА гидратируется под действием еноилгидратазы с образованием b-гидроксиацил-СоА (рис. 9.1). Существуют еноил-СоА-гидратазы, специфичные к цис- и транс-формам еноил-СоА-производных жирных кислот. При этом транс-еноил-СоА гидратируется стереоспецифически в L-b-гидроксиацил-СоА, а цис-изомеры — в D-стереоизомеры -b-гидроксиацил-СоА-эфиров.
Последний этап реакций b-окисления жирных кислот представляет собой дегидрирование L-b-гидроксиацил-СоА (рис. 9.1). Окислению подвергается b-углеродный атом молекулы, поэтому и весь процесс носит название b-окисления. Катализирует реакцию b-гидроксиацил-СоА-дегидрогеназа, специфичная только к L-формам b-гидроксиацил-СоА. Этот фермент использует в качестве кофермента NAD. Дегидрирование D-изомеров b-гидроксиацилСоА осуществляется после дополнительной стадии изомеризации их в L-b-гидроксиацил-СоА (фермент b-гид-роксиацил-СоА-эпимераза). Продукт данного этапа реакций представляет собой b-кетоацил-СоА, легко расщепляющийся тиолазой на 2 производных: ацил-СоА, который короче исходного активированного субстрата на 2 углеродных атома, и ацетил-СоА—двууглеродный компонент, отщепленный от жирнокислотной цепи (рис. 9.1). Ацил-СоА-производное подвергается следующему циклу реакций b-окисления, а ацетил-СоА может вступать в цикл трикарбоновых кислот для дальнейшего окисления.
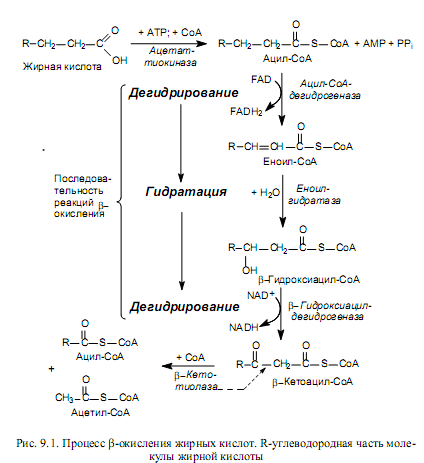
Таким образом, каждый цикл b-окисления жирных кислот сопровождается отщеплением от субстрата двууглеродного фрагмента (ацетил-СоА) и двух пар атомов водорода, восстанавливающих 1 молекулу NAD+ и одну молекулу FAD. Процесс продолжается до полного расщепления жирнокислотной цепи. Если жирная кислота состояла из нечетного числа атомов углерода, то b-окисление завершается образованием пропионил-СоА, который в ходе нескольких реакций превращается в сукцинил-СоА и в таком виде может вступать в ЦТК.
Большинство жирных кислот, входящих в состав клеток животных, растений и микроорганизмов, содержит неразветвленные углеводородные цепи. В то же время в липидах некоторых микроорганизмов и в восках растений присутствуют жирные кислоты, чьи углеводородные радикалы имеют точки ветвления (обычно в виде метильных групп). Если ветвлений немного, и все они приходятся на четные положения (у углеродных атомов 2, 4 и т. д.), то процесс b-окисления происходит по обычной схеме с образованием ацетил- и пропионил-СоА. Если же метильные группы расположены у нечетных атомов углерода, процесс b-окисления блокируется на стадии гидратирования. Это следует учитывать при производстве синтетических детергентов: чтобы обеспечить их быструю и полную биодеградацию в окружающей среде, надо к массовому потреблению допускать лишь варианты с неразветвленными углеводородными цепями.
Окисление ненасыщенных жирных кислот. Этот процесс осуществляется с соблюдением всех закономерностей b-окисления. Однако большинство природных ненасыщенных жирных кислот имеет двойные связи в таких местах углеводородной цепи, что последовательное удаление двууглеродных фрагментов с карбоксильного конца дает ацил-СоА-производное, у которого двойная связь находится в положении 3—4. К тому же двойные связи природных жирных кислот имеют цис-конфигурацию. Чтобы смогла осуществиться стадия дегидрирования с участием b-гидроксиацил-СоА-дегидрогеназы, специфичной к L-формам b-гидроксиацил-СоА, необходима дополнительная стадия ферментативной изомеризации, в ходе которой двойная связь в молекуле СоА-производного жирной кислоты перемещается из положения 3—4 в положение 2—3 и изменяется конфигурация двойной связи из цис- в транс-. Такой метаболит служит субстратом еноил-гидратазы, превращающей транс-еноил-СоА в L-b-гидроксиацил-СоА.
В тех случаях, когда перенос и изомеризация двойной связи оказываются невозможными, такая связь восстанавливается при участии NADPH. Последующая деградация жирной кислоты происходит по обычному механизму b-окисления.
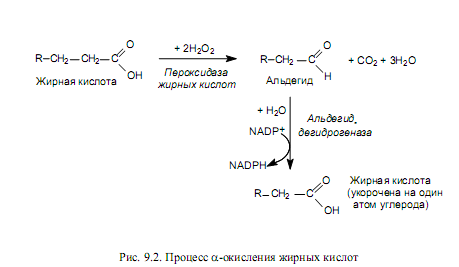
Второстепенные пути окисления жирных кислот. b-Окисление представляет собой основной, но не единственный путь катаболизма жирных кислот. Так, в клетках растений обнаружен процесс a-окисления жирных кислот, содержащих в составе 15— 18 атомов углерода. Этот путь включает первичную атаку жирной кислоты пероксидазой в присутствии перекиси водорода, в результате чего карбоксильный углерод отщепляется в виде СО2, а атом углерода в a-положении окисляется до альдегидной группы. Затем альдегид окисляется при участии дегидрогеназы в высшую жирную кислоту, и процесс повторяется снова (рис. 9.2). Однако этот путь не может обеспечить полного окисления. Он используется лишь для укорочения цепей жирных кислот, а также в качестве обходного пути, когда b-окисление оказывается заблокированным из-за присутствия боковых метильных групп. Процесс не требует участия СоА и не сопровождается образованием АТР.
Некоторые жирные кислоты могут также подвергаться окислению по w-углеродному атому (w-окисление). В этом случае СН3- группа подвергается гидроксилированию под действием монооксигеназы, в ходе которого возникает w-оксикислота, которая затем окисляется до дикарбоновой кислоты. Дикарбоновая кислота может укорачиваться с любого конца посредством реакций b-окисления.
Подобным образом в клетках микроорганизмов и некоторых тканей животных происходит расщепление насыщенных углеводородов. На первой стадии с участием молекулярного кислорода происходит гидроксилирование молекулы с образованием спирта, который последовательно окисляется в альдегид и карбоновую кислоту, активируется присоединением СоА и вступает в путь b-окисления.
Дата добавления: 2016-05-30; просмотров: 3028;











