Катаболизм углеводов
Основными источниками углерода и энергии, а значит, и пищевыми субстратами для большинства организмов (исключая растения) служат углеводы. Среди них на планете в наибольшей мере распространены целлюлоза, ее производные и крахмал. Кроме этих полисахаридов, большое значение имеют гликоген, инулин, хитин, ксиланы, пектиновые вещества и др. Большинство перечисленных полисахаридов расщепляется при участии специфических ферментов на моносахариды, среди которых преобладают гексозы и пентозы. Зачастую расщепление поли- и олигосахаридов осуществляется при участии ферментов фосфорилаз, и тогда образованные продукты оказываются фосфорилированными.
Особенностью сахаров является наличие при каждом атоме углерода атома кислорода, что делает возможным химическую атаку этих субстратов практически в любой точке молекулы. Кроме того, моносахариды и в первую очередь их фосфорилированные формы способны к изомеризации: карбонильные группы, атомы водорода могут легко перемещаться в соседнее положение или изменять свое пространственное положение в молекуле с помощью изомераз. Таким образом, появляется возможность перехода от любой гексозы или пентозы к любой другой, изомерной ей. По этой причине, несмотря на многообразие и сложность процессов обмена углеводов, можно выделить несколько типичных путей их превращения, в частности катаболизма, имеющих выраженные отличительные особенности. Такими путями служат: гликолиз, пентозофосфатные пути и путь Энтнера—Дудорова.
К закономерностям катаболизма моносахаридов относится обязательная начальная стадия активации свободных моноз, которая осуществляется в ходе фосфорилирования. В результате образуются фосфорные эфиры моносахаридов, способные вступать в дальнейшие превращения.
Гликолиз. Этот способ катаболизма сахаров называют иначе фруктозо-1,6-дифосфатным путем (по названию ключевого соединения) или путем Эмбдена—Мейергофа—Парнаса (по именам его исследователей).
Гликолиз считается наиболее универсальным и самым выгодным с энергетической точки зрения путем катаболизма гексоз. Процесс открыт в 1897 г. братьями Бухнерами, и его название происходит от двух греческих корней: glicos — сахар и lysis — растворять. В ходе гликолиза происходит не требующее участия молекулярного кислорода многоэтапное превращение гексоз в пируват, что сопровождается образованием АТР и восстановительных эквивалентов.
Реакции гликолитического пути осуществляются в цитозоле. Все промежуточные соединения имеют фосфорилированную форму. Для запасания энергии используется механизм субстратного фосфорилирования.
Превращение глюкозы в пируват (рис. 9.3) требует участия десяти ферментов и осуществляется в ходе следующих стадий: подготовка к разрыву гексозной цепи, разрыв цепи и образование глицеральдегид-3-фосфата, первое и второе субстратное фосфорилирование.
Процесс начинается с фосфорилирования глюкозы (активация молекулы) с участием АТР (донор фосфатной группы) и фермента гексокиназы. Образующийся глюкозо-6-фосфат в следующей реакции изомеризуется глюкозофосфатизомеразой во фруктозо-6-фосфат, который претерпевает второе фосфорилирование за счет АТР с образованием фруктозо-1,6-дифосфата.
Фруктозо-1,6-дифосфат является ключевым промежуточным продуктом гликолитического пути: именно данное соединение отличает гликолиз от других путей катаболизма сахаров. Кроме того, на уровне этого вещества осуществляется регуляция скорости всего процесса гликолиза. Активность катализирующего данную реакцию фермента (фосфо-фруктокиназы) ингибируется высокими концентрациями АТР, при этом снижается сродство фосфофруктокиназы к субстрату — фруктозо-6-фосфату. Кроме того, фосфофруктокиназа ингибируется цитратом —ранним промежуточным продуктом цикла трикарбоновых кислот. Известна и активация фосфофруктокиназы: ее осуществляют ADP и неорганический фосфат. Таким образом, фосфофруктокиназа наиболее активна в условиях, когда в клетке мало АТР (много ADP) и недостает строительных блоков.
На следующем этапе гликолиза фруктозодифосфат расщепляется с участием фруктозодифосфатальдолазы на два триозофосфата: дигидроксиацетонфосфат и глицеральдегидтрифосфат. Эти продукты представляют собой изомеры и легко переходят один в другой под действием триозофосфатизомеразы. Однако направление этой реакции сдвинуто в сторону образования глицеральдегид-3-фосфата, поскольку он все время выводится из реакционной смеси, претерпевая дальнейшие превращения. Глицеральдегид-3-фосфат служит субстратом первого субстратного фосфорилирования.
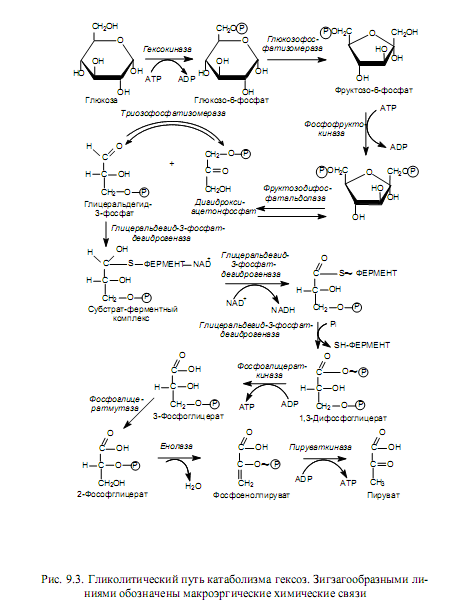
В ходе оставшихся этапов гликолиза, в отличие от предыдущих, энергия выделяется и запасается в форме АТР. Одной из подобных реакций является окисление глицеральдегид-3-фосфата. Фермент, катализирующий данную реакцию (глицеральдегид-3-фосфатдегидрогеназа), использует в качестве кофермента NAD и характеризуется содержанием большого количества сульфгидрильных групп (SH-групп). Окисление начинается со связывания глицеральдегид-3-фосфата с SH-группой фермента — формируется субстратферментный комплекс. Далее фермент катализирует перенос водорода с субстрата на NAD+, и восстановленный кофермент отделяется. Реакция дегидрирования и служит окислительной реакцией, поставляющей энергию: возникает комплекс фермента с ацильным остатком (тиоэфир), богатый энергией. Затем осуществляется фосфоролиз — перенос остатка глицеральдегид-3-фосфата совместно с макроэргической связью на фосфорную кислоту, что приводит к образованию 1,3-дифосфоглицериновой кислоты и исходной формы фермента. 1,3-Дифосфоглицерат представляет собой смешанный ангидрид фосфорной и карбоновой кислот и имеет высокий потенциал переноса фосфатной группы. Богатая энергией фосфатная группа переносится с 1,3-дифосфоглицерата на ADP с участием фосфоглицераткиназы и образованием продуктов: 3-фосфоглицерата и АТР. Так осуществляется первое субстратное фосфорилирование в гликолизе.
Заключительный этап гликолиза — второе субстратное фосфорилирование — начинается со внутримолекулярной перестройки, в ходе которой 3-фосфоглицерат изомеризуется в 2-фосфоглицерат (фермент фосфоглицератмутаза). 2-Фосфоглицерат дегидратируется в фосфоенолпируват при участии енолазы. В результате этой реакции образуется соединение, характеризующееся высоким потенциалом переноса фосфатной группы, таким образом, отщепление молекулы воды от 2-фосфоглицерата сопровождается перераспределением энергии внутри молекулы, и фосфатная связь у 2 атома углерода превращается из низко- в высокоэнергетическую. Последняя реакция гликолиза катализируется пируваткиназой, и в ходе нее фосфатная группа переносится на молекулу ADP и образуется конечный продукт пути — пируват.
Гликолитическое расщепление одной молекулы глюкозы приводит к образованию 4 молекул АТР (по две на каждую молекулу глицеральдегид-3-фосфата), из которых 2 расходуются на образование фруктозодифосфата. Таким образом, запасается всего 2 молекулы АТР. Кроме того, на одну молекулу глюкозы в этом процессе запасается 2 молекулы NADH (при окислении 2 молекул глицеральдегид-3-фосфата). Баланс гликолиза выглядит следующим образом:
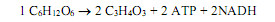
Гликолитический процесс служит клетке для запасания энергии и восстановительных эквивалентов, а также является поставщиком «строительных блоков» в виде трехуглеродного, частично окисленного соединения —пировиноградной кислоты и некоторых промежуточных продуктов, в частности глицеральдегид-3-фосфата.
Пентозофосфатные пути. Эти пути катаболизма сахаров довольно разнообразны. В зависимости от условий и видовой принадлежности организма результатом данных процессов могут быть различные вещества. Осуществление реакций пентозофосфатных путей в обратном направлении используется клетками при фиксации СО2. Основной отличительной особенностью путей является образование в качестве промежуточных соединений пятиуглеродных сахаров, а также последовательное отщепление от 6-углеродного фосфорилированного сахара по одному атому углерода, который высвобождается в среду в виде СО2.
Пентозофосфатные пути (иначе, схема Варбурга—Диккенса—Хореккера, гексозомонофосфатный шунт, фосфоглюконатный путь) реализуются организмами реже, чем гликолиз, и обнаруживаются чаще всего в клетках бактерий.
После традиционной реакции активации глюкозы в ходе фосфорилирования образованный глюкозо-6-фосфат подвергается дегидрированию. Данную реакцию катализирует глюкозо-6-фосфатдегидрогеназа, а восстановительные эквиваленты акцептирует ее кофермент — NADP+. Образуется 6-фосфоглюконолактон (рис. 9.4). Данное соединение подвергается гидролизу (раскрытие кольца) с участием глюконолактоназы, а образованная 6-фосфоглюконовая кислота претерпевает второе дегидрирование (фосфоглюконатдегидрогеназа), после которого сразу же следует декарбоксилирование и образуется рибулозо-5-фосфат. Рибулозо-5-фосфат изомеризуется в два пятиуглеродных сахара — ксилулозо-5-фосфат и рибозо-5-фосфат (рис. 9.4).
Следующий этап пентозофосфатных путей представляет собой многократные межмолекулярные перестройки и изомеризацию промежуточных соединений, формирующихся из рибулозо-5-фосфата. Эти реакции направлены на образование 6-углеродного соединения (глюкозо-6-фосфата), которое может снова подвергнуться окислению и декарбоксилированию. В результате из 6 молекул рибулозо-5-фосфата получается 5 молекул глюкозо-6-фосфата (рис.9.5).
Система структурной перестройки сахаров включает два фермента —транскетолазу и трансальдолазу, которые катализируют перенос двухуглеродных и трехуглеродных фрагментов, разрывая С—С-связи в двух положениях: по соседству с карбонильной (a) и у соседнего с карбонильной группой углеродного атома (b) (на рис. 9.5 места, в которых связи подвергаются расщеплению, обозначены пунктирной линией).
При полном окислении глюкозы в пентозофосфатных путях молекула глицеральдегид-3-фосфата, образующаяся на конечном этапе, подвергается изомеризации с участием триозофосфатизомеразы в дигидроксиацетонфосфат, который затем вступает в реакцию альдольной конденсации со второй молекулой глицеральдегид-3-фосфата, и образуется фруктозодифосфат. Данная реакция является обратимой процессу расщепления фруктозодифосфата, которое имеет место в гликолизе (рис. 9.3), а фермент фруктозодифосфатальдолаза катализирует и прямое, и обратное превращения. Молекула фруктозо-1,6-дифосфата дефосфорилируется с образованием фруктозо-6-фосфата (фермент фосфатаза), а он, в свою очередь, изомеризуется в глюкозо-6-фосфат и возвращается к начальному этапу дегидрирования.
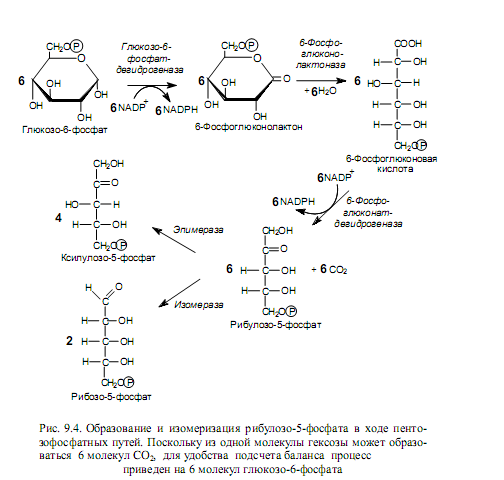
Таким образом, на одну молекулу глюкозы при полном окислении в пентозофосфатных путях затрачивается 1 молекула АТР и образуется 6 молекул СО2 и 12 молекул NADPH. Таким образом, основной задачей пентозофосфатных путей является обеспечение клетки NADPH, который используется в процессах биосинтеза.
В ходе пентозофосфатных путей может и не происходить полного окисления глюкозы. В этом случае глицеральдегид-3-фосфат претерпевает иные превращения, например подвергается реакциям субстратного фосфорилирования под действием ферментов гликолитического пути.
Большое значение пентозофосфатные пути имеют для биосинтетических процессов: здесь образуются промежуточные соединения, играющие роль предшественников многих веществ. В частности, эритрозо-4-фосфат используется бактериями и растениями для синтеза ароматических ами-

нокислот. Рибозо-5-фосфат служит субстратом для синтеза азотистых оснований и некоторых аминокислот.
Путь Энтнера—Дудорова (2-кето-3-дезокси-6-фосфоглюконатный). Этот процесс является еще одним способом катаболизма гексоз и представлен в основном в клетках микроорганизмов. Особое значение данный путь имеет для расщепления глюконата. Начальные стадии превращения глюкозо-6-фосфата совпадают с таковыми для пентозофосфатных путей, вплоть до образования 6-фосфоглюконовой кислоты. Далее, однако, 6-фофоглюконат подвергается а не окислению, а реакции дегидратации, с участием фермента 6-фосфоглюконат-дегидратазы. Образуется ключевое соединение данного пути — 2-кето-3-дезокси-6-фосфоглюко-нат. Стадия дегидратации осуществляется через образование промежуточного соединения (енола), который в результате таутомерного превращения переходит в 2-кето-3-дезокси-6-фосфоглюконат (рис. 9.6).
Далее альдолаза катализирует расщепление ключевого соединения на пируват и глицеральдегид-3-фосфат. Последний может вступать в гликолитический путь и подвергаться дальнейшим превращениям.
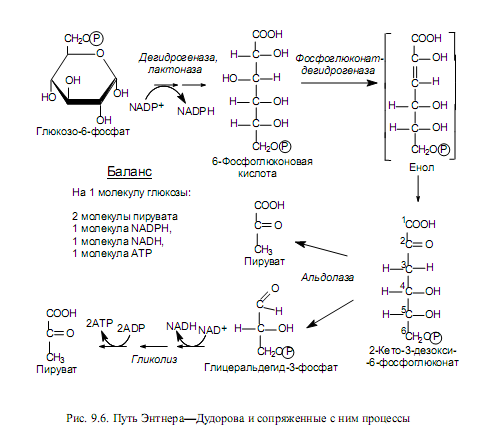
Как следует из баланса пути Энтнера—Дудорова, этот процесс менее выгоден с энергетической точки зрения, чем гликолиз: на молекулу глюкозы здесь запасается только 1 молекула АТР (из двух синтезированных одна тратится на фосфорилирование глюкозы).
Обзор основных катаболических путей позволяет увидеть, что расщепление «топливных» молекул при их неполном окислении сопровождается образованием двух основных метаболитов — пировиноградной кислоты и ацетил СоА. Данные вещества могут использоваться как в биосинтетических путях в качестве «строительных блоков», так и подвергаться дальнейшим превращениям, обеспечивающим запасание клетками энергии. Поскольку в данном разделе обсуждаются процессы, приводящие к запасанию энергии, следует отметить, что судьба пирувата и ацетил-СоА зависит в первую очередь от наличия молекулярного кислорода в клетке, а также от ее ферментативного оснащения. Так, в клетках анаэробных микроорганизмов и тканей высших организмов пируват и ацетил-СоА могут подвергаться различного рода брожениям, завершающим процессы катаболического расщепления субстратов. В аэробных и факультативно-анаэробных клетках при наличии молекулярного кислорода пируват может подвергаться процессу окислительного декарбоксилирования, и образующийся ацетил-СоА вступает в цикл трикарбоновых кислот, где осуществляется его полное окисление до СО2 и Н2О, а формирующиеся восстановительные эквиваленты поступают в дыхательную цепь. Перечисленные процессы будут рассмотрены в следующих главах.
Глава 10. БРОЖЕНИЕ
Брожение со времен Пастера называют «Жизнью без воздуха». Этот тип метаболизма возник на нашей планете одним из самых первых — еще в то время, когда в атмосфере отсутствовал молекулярный кислород. Наиболее древние обитатели Земли использовали этот самый примитивный и наименее выгодный с энергетической точки зрения способ метаболизма для своей жизнедеятельности. В ходе эволюции возникли новые, более перспективные процессы запасания энергии, однако брожение по прежнему используется многими организмами, поскольку позволяет им осуществлять жизнедеятельность в условиях отсутствия молекулярного кислорода.
Брожение происходит в клетках бактерий, дрожжей (для этих микроорганизмов брожение является преобладающим типом метаболизма), простейших, моллюсков, в некоторых тканях рыб и птиц, а также высших животных, включая человека (мышцы, хрусталик и роговица глаза).
Известно большое разнообразие процессов брожения, которые отличаются друг от друга субстратами, продуктами, а также химическими превращениями. При этом можно различить несколько типов брожения, встречающихся наиболее часто: спиртовое, молочнокислое, пропионовокислое, муравьинокислое, маслянокислое, ацетоно-бутиловое. Свое название эти типы брожения получили от доминирующих или характерных продуктов, которые образуются в результате определенной последовательности реакций. Нетрудно заметить, что среди продуктов преобладают органические кислоты и спирты. Субстратами для разных типов брожения служат также органические вещества — в большинстве случаев пируват, а также лактат, ацетил-СоА, некоторые промежуточные метаболиты гликолитического пути, аминокислоты. Таким образом, брожение можно определить как катаболический процесс, происходящий в условиях, не требующих участия молекулярного кислорода, в котором и донорами, и акцепторами электронов являются органические вещества.
Реакциям брожения всегда предшествуют предварительные этапы катаболизма субстратов: чаще гликолиз, реже — пентозофосфатные и фосфоглюконатный пути. Поэтому часто реакции собственно брожения рассматривают в совокупности с предшествующими этапами, и в этом случае можно говорить о запасании энергии в ходе таких процессов. Однако следует помнить, что энергия в форме макроэргических связей АТР запасается в процессе субстратного фосфорилирования, как правило, еще до образования пирувата. В процессах собственно брожения энергия запасается редко, и можно назвать всего три реакции, в которых фосфорилируется ADP: образование масляной, уксусной, а также ацетоуксусной кислот. В брожениях других типов дополнительного количества энергии не образуется, и их основной задачей является регенерация окисленной формы переносчика восстановительных эквивалентов — NAD+. Это необходимо для бесперебойного осуществления реакций гликолиза и других катаболических путей, в ходе которых, как известно, происходит расщепление субстратов, сопровождающееся их окислением, что требует постоянного присутствия в клетке акцепторов восстановительных эквивалентов — NAD+.
Рассмотрев более детально несколько типов брожения, можно убедиться в том, что соблюдается эквивалентность между количеством молекул NADН, образованных в ходе гликолиза, и числом молекул NAD+, сформировавшихся в ходе собственно брожения (при условии, что в метаболизме не принимает участие молекулярный кислород). Таким образом, в анаэробных условиях использующие бродильный тип метаболизма клетки вынуждены тратить существенную часть двух-, трехуглеродных органических веществ для акцептирования водорода, выводя их затем из клетки. Этот крайне непроизводительный процесс приводит к тому, что в анаэробных условиях клетки перерабатывают огромные количества субстрата, чтобы извлечь нужное для жизнедеятельности количество энергии. Неслучайно у многих факультативноанаэробных микроорганизмов выработался механизм подавления процессов брожения в аэробных условиях с переключением на дыхательный метаболизм. При дыхании из одной молекулы глюкозы клетка может извлечь максимально 38 молекул АТР, а при брожении — только 4 (в большинстве случаев всего 2).
Спиртовое брожение
Преобладающим продуктом спиртового брожения является этиловый спирт. Этот тип брожения характерен для определенных видов дрожжей, бактерий, а также мицелиальных грибов. Известно 3 основных способа спиртового брожения, которые отличаются друг от друга тем, какой из трех катаболических путей расщепления глюкозы (и некоторых других сахаров) реализуется: гликолиз, пентозофосфатные пути либо путь Энтнера—Дудорова. Наиболее часто, как отмечалось выше, клетки используют гликолиз, и его конечный продукт — пируват чаще других служит субстратом спиртового брожения.
На рис. 10.1 представлены схемы двух способов спиртового брожения. Первый способ предполагает катаболизм глюкозы по гликолитическому пути (характерен для дрожжей и бактерий Sarcina ventriculi), а второй — по пентозофосфатному (гетероферментативные молочнокислые бактерии). Соответственно различаются участвующие в этих процессах ферменты и спектр продуктов. Третий способ спиртового брожения, который используют бактерии Zymomonas mobilis, отличается тем, что глюкоза катаболизируется по пути Энтнера—Дудорова. Образующийся пируват подвергается декарбоксилированию, как и в первом случае, и ступенчато восстанавливается в этанол. Часть пирувата восстанавливается в молочную кислоту.
На рис. 10.1 наглядно продемонстрировано, что количество затраченных в ходе гликолиза и пентозофосфатного пути молекул NAD+ (NADP+) строго соответствует количеству регенерированных в процессе спиртового брожения молекул NAD+ (NADP+). При этом реакции субстратного фосфорилирования, приводящие к синтезу АТР, имеют место только в катаболических путях до образования пирувата. В реакциях собственно спиртового брожения, связанных с преобразованием пирувата в этанол или лактат, запасание энергии не происходит.
Ход брожения очень сильно зависит от условий, в которых функционируют клетки. Кроме того, у некоторых микроорганизмов существуют отдельные отклонения от приведенных выше классических схем спиртового брожения. В результате спектр продуктов брожения может сильно различаться и включать кроме этанола и лактата примеси: глицерол, ацетальдегид, другие альдегиды, эфиры, кетоны, спирты, в том числе высшие органические кислоты и др.
Дата добавления: 2016-05-30; просмотров: 4146;











