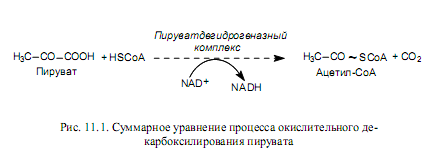
Окислительное декарбоксилирование пирувата
Как показано ранее (глава 9), основным продуктом катаболизма углеводов является пируват. Это трехуглеродное соединение образуется также при окислении многих аминокислот. Для того чтобы пируват мог подвергнуться дальнейшему окислению в ЦТК, он должен быть превращен в ацетил-СоА. Этот весьма сложный процесс осуществляется с участием пируватдегидрогеназного комплекса, который включает три фермента и пять кофакторов. Суммарное уравнение процесса окислительного декарбоксилирования пирувата выглядит довольно просто (рис. 11.1), однако механизм действия всех компонентов пируватдегидрогеназного комплекса включает несколько стадий.
На первой стадии пируватдекарбоксилаза (называется также дегидрогеназой) с помощью своего кофактора — тиаминдифосфата катализирует декарбоксилирование пирувата с образованием оксиэтильного производного (—СНОН—СН3), которое остается связанным с кофактором и ферментом. Затем происходит перенос оксиэтильного остатка на молеку-
лу липоевой кислоты, которая служит кофактором второго фермента комплекса — липоат-ацетилтрансферазы. Перенос завершается окислением оксиэтильного остатка до ацетильной группы и частичным восстановлением липоевой кислоты. На третьей стадии ацетильная группа переносится от липоевой кислоты на тиоловую группу коэнзима А, в результате чего ацетил-СоА отделяется от комплекса и образуется полностью восстановленная форма липоевой кислоты — дигидролипоевая кислота. Последняя стадия процесса катализируется третьим ферментом—дигидролипоилдегидрогеназой, содержащей FAD в качестве простетической группы. Этот фермент катализирует окисление дигидролипоевой кислоты в липоевую с восстановлением FAD до FADH2 . Наконец, восстановительные эквиваленты от FADH2 передаются на NAD+, который транспортирует их в дыхательную цепь.
Следует отметить, что в составе сформированного в процессе окислительного декарбоксилирования пирувата продукта — ацетил-СоА —появляется макроэргическая связь (обозначена волнистой линией на рис. 11.1).
Активность пируватдегидрогеназного комплекса зависит от количества АТР в клетке и регулируется с привлечением механизма ферментативной модификации белка: АТР-зависимая протеинкиназа осуществляет фосфорилирование определенных аминокислотных остатков в пируватдекарбоксилазной субъединице, в результате чего фермент утрачивает активность. Обратное действие (восстановление активности пируватдекарбоксилазы) совершает особая фосфатаза, которая дефосфорилирует белковую молекулу.
Химизм ЦТК
Реакции цикла трикарбоновых кислот осуществляются у эукариот в митохондриях — там же, где функционируют системы, поставляющие «топливо» для ЦТК: b-окисление жирных кислот, окислительное декарбоксилирование пирувата. Считается, что ферменты, принимающие участие в ЦТК, сгруппированы в особый каталитический комплекс, расположенный между внутренними мембранами митохондрий. Структура комплекса такова, что промежуточные продукты цикла последовательно переходят от одного фермента к другому, не высвобождаясь в матрикс. В этом случае скорость процесса значительно увеличивается.
Все реакции ЦТК можно условно разделить на 4 стадии: 1) акцептирование ацетил-СоА и образование изоцитрата; 2) окислительное декарбоксилирование изоцитрата; 3) окислительное декарбоксилирование a-кетоглутарата; 4) регенерация акцептора ацетил-СоА.
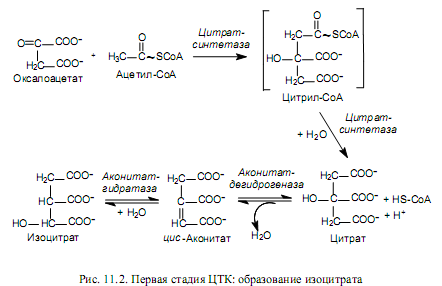
Акцептором ацетил-СоА является оксалоацетат (щавелевоуксусная кислота, ЩУК). Это четырехуглеродное соединение конденсируется с двухуглеродным компонентом ацетил-СоА при участии фермента цитратсинтетазы. Данная реакция альдольной конденсации протекает ступенчато, с образованием промежуточного продукта — цитрил-СоА, гидролиз которого сдвигает направление реакции в сторону образования цитрата (рис. 11.2).
Чтобы могло осуществиться окислительное декарбоксилирование шестиуглеродного соединения, цитрат (лимонная кислота) должен изомеризоваться в изоцитрат. Этот процесс катализируется аконитазой и представляет собой реакцию дегидратации с последующей гидратацией.
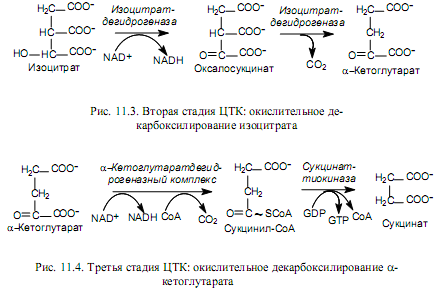
Окислительное декарбоксилирование изоцитрата катализируется изоцитратдегидрогеназой, которая использует NAD в качестве кофермента. Изоцитрат окисляется в b-кетокислоту, оксалосукцинат, который быстро теряет карбоксил, будучи связанным с ферментом, и превращается в a-кетоглутарат (рис. 11.3).
На третьей стадии (рис. 11.4) a-кетоглутарат также подвергается окислительному декарбоксилированию. Эту реакцию катализирует организованный ансамбль ферментов — a-кетоглутарат-дегидрогеназный комплекс. Состав ансамбля сходен с комплексом, катализирующим окислительное декарбоксилирование пирувата, и оба процесса имеют множество общих деталей. Продуктом реакции является четырехуглеродное активированное соединение —сукцинил-СоА. Макроэргическая связь сукцинильного тиоэфира расщепляется с участием сукцинаттиокиназы, и это сопряжено с фосфорилированием GDP (у млекопитающих) или АТР (у бактерий, высших растений)
Образование высокоэнергетической связи GTP или АТР при гидролизе сукцинил-СоА является единственным случаем субстратного фосфорилирования, который имеет место в ЦТК.
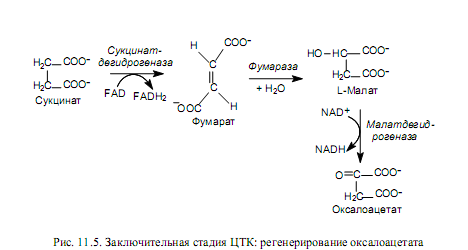
Образовавшийся на предыдущей стадии сукцинат (янтарная кислота) в ходе нескольких реакций (окисление, гидратация, окисление) превращается в оксалоацеат (рис. 11.5). Данная последовательность превращений представляет собой процесс b-окисления, который уже был рассмотрен по отношению к жирным кислотам в главе 9. Реакции последней стадии ЦТК представляют собой регенерирование оксалоацетата. Окисление сукцината катализирует сукцинатдегидрогеназа. Этот фермент непосредственно связан с цепью переноса электронов, и в отличие от других ферментов ЦТК является интегральным белком внутренней мембраны митохондрий.
Продукт окисления сукцината — фумарат — гидратируется фумаразой. Происходит стереоспецифическое присоединение водорода и гидроксила с образованием L-малата (яблочной кислоты). Наконец, L-малат окисляется в оксалоацетат малатдегидрогеназой.
Полностью циклическая система реакций ЦТК представлена на рис. 11.6. Многие промежуточные вещества ЦТК служат предшественниками в биосинтетических реакциях. Например, оксалоацетат и a-кетоглутарат используются в биосинтезе аминокислот. Оксалоацетат включается в процесс глюконеогенеза (образование глюкозы из неугл-
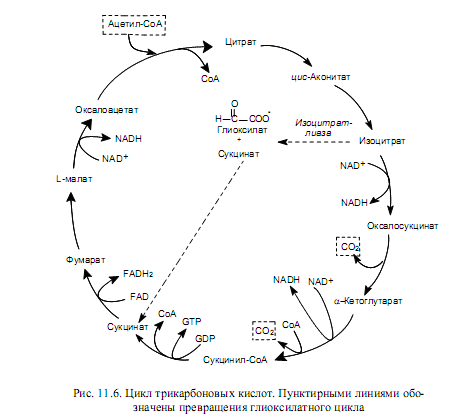
водных субстратов). Большинство углеродных атомов в порфиринах ведут свое происхождение от сукцинил-СоА. Однако потребление промежуточных продуктов ЦТК для целей биосинтеза обязательно должно сопровождаться их восполнением, в противном случае цикл прервется. В норме между реакциями, за счет которых определенные промежуточные продукты удаляются из цикла и, наоборот, поступают в цикл, существует состояние динамического равновесия.
Восполняющие запас промежуточных продуктов ЦТК реакции носят название анаплеротических. Одной из основных анаплеротических реакций клеток млекопитающих является карбоксилирование пирувата с образованием оксалоацетата. Катализирует это превращение аллостерический фермент — пируваткарбоксилаза. Его активатором служит субстрат ЦТК —ацетил-СоА. В условиях накопления ацетил-СоА стимулируется активное карбоксилирование пирувата и увеличивается количество оксалоацетата, который служит непосредственным акцептором ацетил-СоА.
В клетках бактерий и растений восполнение оксалоацетата осуществляет другой фермент — фосфоенолпируват-карбоксилаза.
Баланс ЦТК
На рис. 11.6 показано, что каждый оборот цикла трикарбоновых кислот сопровождается поступлением в него двух атомов углерода (в виде молекулы ацетил-СоА) и выходом из него двух атомов углерода (в виде двух молекул СО2). В молекуле СО2 достигается высшая степень окисленности углерода.
Окисление углерода сопровождается отщеплением от промежуточных продуктов ЦТК четырех пар атомов водорода. Это сопровождается восстановлением 3 молекул NAD+ и 1 молекулы FAD, образуется 3 молекулы NADH и 1 молекула FADH2. Регенерация окисленных форм переносчиков восстановительных эквивалентов происходит в дыхательной цепи, где конечным акцептором электронов выступает молекулярный кислород. Поэтому ЦТК функционирует только в аэробных условиях, несмотря на то что молекулярный кислород не принимает непосредственного участия в реакциях цикла.
Каждый оборот ЦТК обеспечивает запасание энергии на уровне субстратного фосфорилирования: синтезируется одна молекула АТР (либо GTP).
Общая стехиометрия ЦТК:
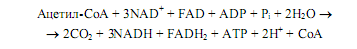
Регуляция ЦТК
Скорость функционирования ЦТК регулируется на нескольких уровнях и оказывается точно пригнанной к потребностям клетки. Основной реакцией, лимитирующей интенсивность оборотов цикла, является окислительное декарбоксилирование изоцитрата. Изоцитратдегидрогеназа представляет собой аллостерический белок, активируемый аденозиндифосфатом, который повы шает сродство фермента к субстратам. Ингибитором активности изоцитратдегидрогеназы служит NADH, который «вытесняет» из активного центра NAD+.
Другой фермент ЦТК — цитратсинтетаза — испытывает ингибирование со стороны АТР: с увеличением содержания АТР в клетке снижается насыщение активного центра фермента ацетил-СоА и, как следствие, уменьшается скорость образования цитрата.
Еще один фермент ЦТК — сукцинатдегидрогеназа изменяет свою активность в процессе аллостерической регуляции: активируется фосфатом и сукцинатом, а ингибируется оксалоацетатом. При накоплении в клетке ЩУК не происходит окисление сукцината.
Наконец, активность a-кетоглутаратдегидрогеназы аллостерически ингибируется продуктами катализируемой этим ферментом реакции —сукцинил-СоА и NADH.
Следует отметить, что у разных организмов могут существовать различные, в том числе не охарактеризованные здесь способы регуляции скорости реакций ЦТК.
Дата добавления: 2016-05-30; просмотров: 6045;











