На катоде восстанавливаются в первую очередь катионы с большим значением стандартного электродного потенциала.
Возможные катодные процессы при электролизе водных растворов:
- восстановление молекул воды в нейтральных и щелочных растворах (pH≥7): 2НОН - + 2ē → Н2 ↑+ 2OH- Е0 = -0,83 (В)
- восстановление ионов водорода в кислых растворах (pH£7):
2Н+ + 2ē → Н2 ↑ Е0 = от 0 (В)  до -0,41 (В)
до -0,41 (В)
- восстановление катионов металла: Мn+ +nе-→ M0
В связи с этим можно выделить три группы катионов по отношению к электровосстановлению:
а) если в растворе электролита, подвергающегося электролизу, есть катионы М+n, которые стоят в ряду напряжений между Li-Al, то восстанавливаются только молекулы Н2О:
2Н2О 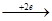 Н2 + 2ОН - (Е=-0,83в);(pH≥7)
Н2 + 2ОН - (Е=-0,83в);(pH≥7)
или восстанавливаются только ионы водорода: 2Н+ 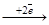 H2, если электролизу подвергается раствор кислоты; б) если в растворе электролита есть катионы М+n, которые стоят в ряду напряжений между Ti-H , то восстанавливаются вода и катион М+n: (pH≥7): или Н+ и катион М+n (pH<7):
H2, если электролизу подвергается раствор кислоты; б) если в растворе электролита есть катионы М+n, которые стоят в ряду напряжений между Ti-H , то восстанавливаются вода и катион М+n: (pH≥7): или Н+ и катион М+n (pH<7):
в) если в растворе содержатся катионы М+n, которые стоят в ряду напряжений после Н, то на катоде восстанавливаются только ионы Меn+
М+n 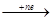 M0;(pH<7; pH≥7)
M0;(pH<7; pH≥7)
Окисление ионов на аноде: на аноде окисляются в первую очередь анионы с меньшим значением электродного потенциала.
Возможные анодные процессы при электролизе водных растворов:
- окисление молекул воды (рН < 7): 2Н2О - 4ē → О2 + 4Н+; Е0=+ 1,23 (В)
- окисление ОН 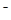 ионов (рН ≥ 7) : 4ОН- - 4ē → О2 + 2Н2О;Е0=+ 0,40 (В)
ионов (рН ≥ 7) : 4ОН- - 4ē → О2 + 2Н2О;Е0=+ 0,40 (В)
- анионы кислот по отношению к электроокислению делят на 2 группы:
а) анионы кислород не содержащих кислот (Cl-, Br-, I-, S2-) легко окисляются: 2I- 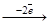 I2; E0 = +0,54 (B);
I2; E0 = +0,54 (B);
б) анионы кислород содержащих кислот (SO42-, NO3-, CO32-, PO43-) удерживают электроны прочнее, чем молекулы воды, поэтому на аноде окисляется вода по приведенной выше схеме.
- растворение анода:. M0 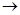 М+n +n ē
М+n +n ē
Различают растворимые электроды (Cu;Zn и т.д.) и инертныеэлектроды (C; Au; Pt).
Рассмотрим пример электролиза раствора хлорида меди (ll) с растворимым медным анодом:
CuCl2 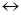 Cu2+ + 2Cl-
Cu2+ + 2Cl-
К - Cu2+ (E0 = + 0,34 В) А+(Cu) Cl-( E0 = +1,36 B)
H2O (E0 = - 0,83 В) H2O (E0 = +1,23) 
Cu0 (E0 = + 0,34 )
восстанавливаетсяся частица окисляется частица с
с большим потенциалом меньшим потенциалом.
Cu2+ 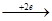 Cu0 Cu0
Cu0 Cu0 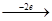 Cu2+
Cu2+
Этот способ используют для электролитического рафинирования металлов (очистка) в промышленных условиях.
Для того, чтобы произошла разрядка ионов на электродах, к ним надо приложить определенную электродвижущую силу, равную разности потенциалов, называемую потенциалом разложения (Е0разл.), который численно равен по модулю электродвижущей силе гальванического элемента, составленного на основе продуктов электролиза. Например:
рассчитать потенциал разложения 1М соляной кислоты.
HCl ↔ H+ + Cl-
окислитель К- 2Н+ + 2ē → Н2 восстановление
восстановительА+ 2Cl- - 2ē → Cl2 окисление.
ЭДС = ЕК0 – ЕА0 = 0 – 1,36 =│1,36│В.
Последовательность разрядки ионов при электролизе может нарушаться из-за явления называемого перенапряжением. Перенапряжение равно разности между напряжением положенным на электроды и ЭДС гальванического элемента, отвечающего обратной реакции. Поэтому, делая расчеты реальных электрохимических процессов, необходимо помнить, что реальная разность потенциалов при электролизе (ΔЕ) слагается из: потенциала разложения (Еразл.), ЭДС для преодоления сопротивления электролита, суммы катодного и анодного перенапряжения, которые обусловлены побочными процессами, происходящими на электродах, такими как:
- подход иона к электроду;
- потеря ионом гидратной оболочки (в растворе);
- разрядка иона;
- рекомбинация атомов в молекулы;
- отход молекулы от электрода.
ΔЕразл. = Еразл. + IR + ΔЕполяриз. + ΔЕконтакт.,,
где I – сила тока при электролизе;
R – сопротивление систем;
ΔЕполяриз. – разность потенциалов поляризации, препятствующая прохождению тока;
ΔЕконт. – сумма контактных потенциалов.
R – общее сопротивление системы, равное сумме сопротивлений электролита, диафрагмы электролизера и токоподводов к электролизеру.
Опыт показывает, что потенциалы выделения Е0(Men+) примерно равны их электродным потенциалам, а Е0выделения газов значительно больше их электродных потенциалов. Это объясняется так называемой газовой поляризацией, т.е. образованием на электродах «газовой шубы» за счет выделения водорода на катоде, а кислорода на аноде, или других газов. Газовая поляризация может остановить процессы, протекающие при электролизе, из-за изоляции электродов. Её негативное влияние может быть устранено добавлением окислителей водорода:K2Cr2O7, KMnO4  и восстановителей кислорода Na2SO3, Na3PO4
и восстановителей кислорода Na2SO3, Na3PO4  .
.
Кроме газовой поляризации, различают:
- концентрационную – за счет изменения концентрации в
приповерхностном слое электрода, если анод медный, то [Cu2+] у анода больше, чем у катода. Для устранения такой поляризации, необходимо перемешивать электролит;
- химическую– возникает вследствие того, что выделение продуктов
электролиза приводит к образованию гальванической цепи (идет обратная электролизу реакция).
Количественные соотношения при электролизе установлены в 1827г английским физиком Майклом Фарадеем.
Законы Фарадея:
1 закон: массы веществ, выделившихся на электродах прямопропорциональны количеству электричества (Q), прошедшего через раствор или расплав электролита
m =k . Q; Q=I·t ;
Q-количество электричества, А . с;
I-сила тока, А;
t-время ,с ,ч;
k - электрохимический эквивалент , г/Кл.
Масса вещества, выделившегося при прохождении через электролит одного кулона электричества, называется электрохимическим эквивалентом
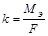 ;
; 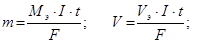 где
где
m – масса вещества, г;
V – объем вещества, л;
Мэ – молярная масса эквивалента, г/моль;
Vэ - эквивалентный объем, л/моль;
F – число Фарадея 96500 Кл/моль, 26,8 А·ч/моль.
II закон: при прохождении через различные электролиты одинакового количества электричества на электродах выделяются массы веществ, пропорционально молярным массам их эквивалентов(химические эквиваленты пропорциональны электрохимическим).
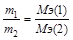

Вследствие протекания побочных процессов на электродах, образуется реально меньшее количество вещества, чем теоретически рассчитанное по вышеуказанной формуле. Для характеристики истинного количества вещества, выделяющегося на электродах, введено понятие выход по току (h).
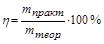 .
.
Задача. Составить схему электролиза раствора сульфата натрия. Написать уравнения катодного и анодного процессов, рассчитать количество образовавшихся при электролизе веществ (для газообразных – объем), если выход по току 70%, а через раствор пропускали ток силой 2А в течение 10 минут.
Сульфат натрия в растворе диссоциирует
Na2SO4 ↔ 2Na+ + SO42-
H2O
На катоде идет восстановление тех частиц, потенциал которых больше, 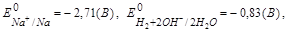
поэтому на катоде будет восстанавливаться вода по схеме:
К-: 2НОН + 2ē → Н2↑ + 2ОН -
к аноду направляются ионы SO42- и H2O.
На аноде окисляются те частицы, електрдный потенциал которых имеет меньшее значение,
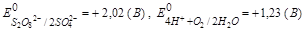 , поэтому будет идти окисление воды по схеме:
, поэтому будет идти окисление воды по схеме:
А+: 2Н2О - 4ē → О2 + 4Н+.
Суммарное уравнение электролиза Na2SO4
2Na2SO4 + 6H2O  2H2 + 4NaOH + O2 + 2H2SO4
2H2 + 4NaOH + O2 + 2H2SO4
на катоде у катода на аноде у анода
По закону Фарадея рассчитаем объемы V(Н2), V(О2) и массы m (NaOH), m (H2SO4), зная, что выход по току  (ή) составляет 70%.
(ή) составляет 70%.
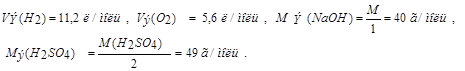
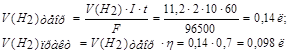
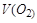 определяем по второму закону Фарадея:
определяем по второму закону Фарадея:
Дата добавления: 2020-04-12; просмотров: 855;











