Электролизом называется окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита.
В растворах и расплавах электролитов разноименно заряженные ионы (анионы - отрицательно заряженные ионы, катионы - положительно заряженные ионы), находятся в хаотическом движении. Рассмотрим электролиз расплава хлорида натрия (NaCl). При плавлении хлорид натрия диссоциирует:
NaCl  Na+ + Cl-
Na+ + Cl-
Если через такую систему пропустить постоянный электрический ток, то катионы натрия начнут упорядоченно перемещаться к катоду (К -), а анионы хлора - к аноду (А+). На электродах будет протекать окислительно-восстановительная реакция
 Восстановление К- Na++ē
Восстановление К- Na++ē 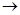 Na0 2 Na+ принимает электроны с у катода: катода
Na0 2 Na+ принимает электроны с у катода: катода
Окисление A+ 2Cl - - 2ē 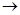 Cl201 Cl - отдает электроны аноду
Cl201 Cl - отдает электроны аноду
 у анода:
у анода:
2Na+ + 2Cl- 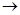 2Na + Cl2
2Na + Cl2
В этом заключается сущность электролиза.
Уравнение электролиза:2NaCl 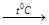 2Na+ + 2Cl-
2Na+ + 2Cl-  2Na + Cl2
2Na + Cl2 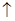 .
.
Восстановительные и окислительные свойства электрического тока во много раз сильнее действия химических восстановителей и окислителей. Например, окисление иона F- происходит только при электролизе KF в HF:
К- 2H+ + 2ē 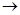 H2
H2
A+ 2F- - 2ē 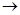 F2.
F2.
Продуктами электролиза расплава являются составные части расплавленного электролита.
Электролиз растворов электролитов достаточно сложен, поскольку в электролите присутствуют всегда несколько видов катионов и анионов, а также недиссоциированные молекулы электрически активных веществ например, воды. Последовательность протекания электродных процессов определяется значениями их стандартных электродных потенциалов и величиной поляризации.
Восстановление ионов на катоде:
Дата добавления: 2020-04-12; просмотров: 569;











