Основы электрохимии.
При погружении металлической пластинки, свободной от оксидной пленки, в раствор электролита на границе металл — раствор электролита возникает двойной электрический слой (ДЭС), характеризующийся определённой разностью потенциалов или определённым электродным потенциалом.
ДЭС возникает в результате перехода заряженных частиц через границу раздела двух фаз металл (М), твердая фаза (т) — раствор электролита (ж). При его формировании, например, в случае металлической пластинки, погруженной в воду, протекают следующие процессы:
1. Отрыв положительно заряженных ионов (катионов) от поверхности металла и переход их в раствор.
М (т)→М 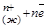
2. Избыток электронов, остающихся в металле, заряжает его поверхность отрицательно.
3. Гидратация катионов полярными молекулами воды, в объёме жидкой фазы (сольватация молекулами растворителя)
М  +nH
+nH  O→М
O→М  ·nH
·nH  O
O 
Выше перечисленные процессы (1,2,3)протекают одновременно и поэтому их общее уравнение можно записать:
М (т)+nH  O→М
O→М  ·nH
·nH  O
O  +n
+n 
4. Концентрирование гидратированных (сольватированных) катионов в прилегающем к поверхности металла слое жидкости вследствие их взаимодействия с отрицательно заряженной поверхностью. Положительно заряженные катионы притягиваются отрицательно заряженной поверхностью. Формируется ДЭС, характеризующийся электродным потенциалом.
5. С ростом скачка потенциала между металлом и раствором электролита всё с большей скоростью начинают протекать обратные процессы, дегидратация ионов металла и их последующее восстановление до атомов.
М (ж)) 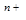 ·nH
·nH  O+n
O+n  → М (т) +nH
→ М (т) +nH  O
O
6. При некотором скачке потенциала наступает равновесие:
М (т) +nH  O
O  М (ж))
М (ж))  ·nH
·nH  O+n
O+n  .
.

Рис. 12. Схема возникновения обменного двойного электрического слоя и электродного потенциала на границе металл-раствор электролита.
Равновесный электродный потенциал (или просто электродный потенциал) - это скачок потенциала, установившийся между металлом раствором электролита в условиях равновесия.
Величина электродного потенциала, а также толщина двойного электрического слоя зависят от природы металла, температуры и активности (концентрации) ионов в растворе. ДЭС имеет диффузное строение, поэтому абсолютное значение электродного потенциала определить невозможно. Однако, если использовать электрод сравнения, потенциал которого условно принят равным нулю (Е1= 0(В)), можно вычислять электродные потенциалы неизвестных полуэлементов (Е2), относительно электрода сравнения при помощи уравнения: Э.Д.С. (DЕ) = Е1 – Е2.
На практике пользуются относительным (условным ) значением равновесного электродного потенциала , обозначаемым 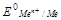 .
.
Стандартный относительный электродный потенциал 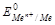 - это величина равная электродвижущей силе электрохимической ячейки, составленной из электрода, опущенного в раствор с активностью ионов металла, равной 1моль/л при 25 0С (298К), при Р=1.03.105 Па, и электрода сравнения.
- это величина равная электродвижущей силе электрохимической ячейки, составленной из электрода, опущенного в раствор с активностью ионов металла, равной 1моль/л при 25 0С (298К), при Р=1.03.105 Па, и электрода сравнения.
В качестве электрода сравнения используют стандартный водородный электрод (рис.2). Конструктивно он состоит из платиновой пластинки (покрытой слоем электролитической платины - платиновой чернью), частично погруженной в раствор, содержащий ионы водорода (обычно раствор H2SO4 или HCl) . К пластинке подается чистый газообразный водород под постоянным давлением. В кислой среде водородному электроду H3O+ /H2 , Pt отвечает уравнение электродного процесса 2H3O+ (ж) +2 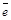
 H2 (Г) + 2H2O (ж), которое в упрощенном виде записывается: 2Н+(ж) +2
H2 (Г) + 2H2O (ж), которое в упрощенном виде записывается: 2Н+(ж) +2 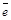
 H2 (Г).
H2 (Г).

Рис.13. Водородный электрод.

Рис.14. Измерение стандартных электродных потенциалов
В схематической записи водородный электрод представляют так:  , если платина служит анодом или
, если платина служит анодом или
 , если платина служит катодом.
, если платина служит катодом.
Использование водородного электрода позволяет измерить относительный электродный потенциал любого полуэлемента, составляя с его помощью химический источник тока (рис.3).
Если водородный электрод играет роль отрицательного электрода, схематическая запись составленного таким образом химического источника тока имеет вид: А- PtêH2(г) êН+(ж) êêМn+ (ж) êМ (т) К+. Следовательно,
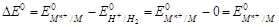 .
.
Если водородный электрод играет роль положительного электрода. А - М (т) êМn+ (ж) êê Н+(ж) ê H2(г) ê Pt К+, то 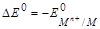 .
.
Таким образом, стандартный электродный потенциал рассматриваемого полуэлемента равен стандартной э.д.с. химического источника, состоящего из этого полуэлемента и стандартного водородного электрода.
В нестандартных условиях электродный потенциал расчитывают по уравнению Нернста:

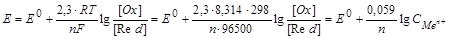
[OX]-концентрация окислителя;
[Red]-концентрация восстановителя;
(ОФ) - окисленная форма;
(ВФ) - восстановленная форма;
R=8.314 Дж/К.моль (универсальная газовая постоянная);
Е0-относительный стандартный электродный потенциал (табличные данные); измеряется в вольтах (В);
Т-абсолютная температура (298К);
F-число Фарадея, равное 96500 (Кл/моль);
n-число электронов, участвующих в процессе;
С-молярная концентрация катионов металла (моль/л).
Е=Е0+0.059/n.lgCMen+, если CMen+=1 моль/л, то Е = Е0.
Задача. Вычислить электродный потенциал золотой пластины, опущенной в раствор соли с концентрацией [Au3+], равной 0.1 моль/л.
Решение:
Поскольку условия, описываемые в задаче, отличаются от стандартных, т.е. СAu3+¹1 моль/л, а составляет 0,1 моль/л по условию задачи, следовательно, для рассчета электродного потенциала необходимо использовать уравнение Нернста:
ЕAu3+/Au=1.5+(0.059/3).lg10-1=1.48 (В).
Понятие стандартный электродный потенциал введено для того, чтобы можно было сравнить окислительно-восстановительные свойства различных систем по их стандартным потенциалам.
В соответствии со значениями стандартного электродного потенциала был составлен электрохимический ряд напряжений металлов.
K Ca Mg Al Zn Fe Pb H+ Cu Ag Au
-3.0 -2.9 -2.4 -1.7 -0.76 -0.44 -0.13 0 +0.34 +0.8 +1.5
1.Все металлы, стоящие левее водорода , имеют отрицательные значения стандартных электродных потенциалов , правее –положительные .Соглашение о знаках потенциалов было принято в 1953г. на конгрессе Международного союза теоретический и прикладной химии (ИЮПАК) . Условились приписывать потенциалу тот знак , который имеет электрод в паре со стандартным водородным электродом .
2. Отрицательные значения свидетельствуют, что данные металлы являются восстановителями по отношению к водороду, т.е. вытесняют (восстанавливают его из растворов минеральных кислот с 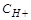 =1 моль/л, анионы которых не проявляют окислительных свойств (HCl , разб.H
=1 моль/л, анионы которых не проявляют окислительных свойств (HCl , разб.H  SO
SO  ))
))
Zn+2HCl→ZnCl  +H
+H  ↑;
↑;  E0 Znn+ /Zn= -0.763 B
E0 Znn+ /Zn= -0.763 B
и разлагают воду
2Na+2H  O→2NaOH+H
O→2NaOH+H  ↑;
↑;  E0Na+ /Na = -2.711 B
E0Na+ /Na = -2.711 B
3. Чем более отрицательно значение электродного потенциала, тем выше способность металла отдавать свои ионы в раствор, т.е. тем сильнее выражена восстановительная способность его восстановленной формы (способность отдавать электроны) и ниже окислительная способность его окисленной формы (способность принимать электроны).
4.Положительное значение потенциала означает, что данные ионы металлов являются окислителями по отношению к водороду, т.е. не разлагают воду и не вытесняют его из растворов, в которых 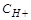 =1моль/л. Наоборот, водород вытесняет металлы из растворов их солей.
=1моль/л. Наоборот, водород вытесняет металлы из растворов их солей.
5. Среди металлов с положительным значением стандартного электродного потенциала, каждый предыдущий металл вытесняет все последующие из растворов их солей. Например: Cu+HgCl2→CuCl2+Hg.
Дата добавления: 2020-04-12; просмотров: 632;











