КОРРОЗИЯ МЕТАЛЛОВ И ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ.
План
1. Определение понятия «коррозия металлов».
2. Классификация коррозионных процессов
2.1. по виду изменения поверхности металла;
2.2. по механизму;
2.3. по характеру дополнительных воздействий.
3. Химическая коррозия, ее виды. Химизм.
4. Электрохимическая коррозия, ее виды и химизм.
5. Факторы, влияющие на скорость коррозии.
6. Защита металлов от коррозии.
Литература:
1. Фролов В.В. Химия. Гл.V, §51-56.
2. Лучинский Г.П. Курс химии. Гл.V, §8-12, гл. VI, §13-18
3. Общая химия под ред. Соколовской Е.М. и др. Гл.6, §1-11.
4. Абраменко В.Л. Методические указания к самостоятельному изучению темы “Коррозия и защита металлов от нее”. Луганск, 1991 г.
Металлы вследствие своей высокой прочности, пластичности, износоустойчивости, тепло- и электропроводности являются наиболее важными конструкционными материалами.
В процессе эксплуатации в результате воздействия окружающей среды происходит их разрушение, так называемая коррозия.
Потери от коррозии в ведущих индустриальных странах составляют около 3-5% валового национального продукта, а затраты на возмещениекоррозионных потерь во всем мире исчисляются сотнями миллиардов долларов, поэтому раздел «Коррозия металлов и методы защиты их от коррозии» является одним из важнейших в курсе химии для инженерных специальностей.
Обычно корродируют металлы, которые встречаются в природе не в самородном состоянии, как Au, Pt, а в виде различных руд. На извлечение этих металлов из природных соединений расходуется значительное количество энергии (Ме+n + nē → Me0; ΔG>0), которая накапливается в металлах, делая их термодинамически неустойчивыми, химически активными веществами (Ме0 - nē → Me+n; ΔG<0). В результате такого самопроизвольно протекающего коррозионного процесса металлы переходят в оксиды, гидроксиды, карбонаты, сульфиды и другие соединения и теряются безвозвратно.
Итак, коррозию можно определить как самопроизвольно протекающий окислительно-восстановительный процесс (ΔG<0) разрушения металла под воздействием окружающей среды, происходящий с выделением энергии (ΔН<0) и рассеиванием вещества (ΔS>0).
Механическое разрушение металлов, происходящее по физическим причинам, не называют коррозией, а называют эрозией, истиранием, износом.
По характеру разрушения поверхности коррозию подразделяют на сплошную и местную. Сплошная коррозия подразделяется на равномерную, если процесс окисления происходит по всей поверхности металла с одинаковой скоростью, и неравномерную – процесс окисления происходит по всей поверхности с различной скоростью на различных участках металла.
Местная коррозия подразделяется на коррозию пятнами, точечную, питтинг (углубленно-точечную), межкристаллитную(наиболее опасна, т.к. ослабляет связи между зернами структуры сплавов), растрескивающуюся, селективную (избирательную).
По механизму протекания различают следующие виды коррозии:
- химическая (газовая, жидкостная);
- электрохимическая (концентрационная, контактная, электрокоррозия);
- особые виды (биологическая, радиационная, ультразвуковая).
По характеру дополнительных воздействий различают:
- коррозию под влиянием механических напряжений;
- коррозию при трении;
- кавитационную коррозию (возникает при одновременном коррозионном и ударном воздействии агрессивной среды, когда лопаются пузырьки воздуха при работе лопастей гребного винта, роторов насосов).
Рассмотрим более подробно виды коррозии по механизму протекания.
Под химической коррозией понимают разрушение металлов окислением в окружающей среде без возникновения электрического тока в системе.
Газовая коррозия протекает при обычных условиях, но чаще при высоких температурах. Наблюдается при разливе расплавленных металлов, их термической обработке, ковке, прокатке, сварке и т.д.
Самый распространенный случай газовой коррозии – взаимодействие металла с кислородом:
xMe + 1/2yO2 → MexOy
4Fe + 3O2 → 2Fe2O3
Образующаяся при такой коррозии оксидная пленка в ряде случаев играет защитную функцию. Для этого она должна быть сплошной, беспористой, иметь хорошее сцепление с металлом, обладать твердостью, износостойкостью и иметь коэффициент термического расширения, близкий к этой величине для металла. Все эти качества оксидной пленки можно оценить по фактору Пиллинга-Бэдвордса (a). Металлы (щелочные, щелочноземельные), у которых a<1 имеют тонкие оксидные пленки с разрывами. Сплошные и устойчивые оксидные слои образуются при a=1,2 – 1,6 (например, Al2O3, ZnO, NiO и т.д.). При значениях a значительно больше единицы пленки получаются неслошные, лекго отделяющиеся от поверхности металла (железная окалина).Коррозионно-активными газами, кроме кислорода, являются: угарный газ, углекислый газ, сернистый ангидрид, азот, его оксиды и галогены. Например, при разливе расплавленного алюминия, происходит его взаимодействие не только с кислородом, но и с азотом воздуха.
4Al + 3O2 → 2Al2O3; 2Al + N2 → 2AlN.
Жидкостная коррозия протекает, как правило, в жидких неэлектролитах: спиртах, хлороформе, бензоле, бензине, керосине и других нефтепродуктах. Ускоряет процесс жидкостной коррозии сера,кислород, галогены, влага, атакже повышенная температура (коррозия поршней в двигателях внутреннего сгорания),что можно описать уравнениями : Me(II) + R1 – S – R2 → MeS + R1 – R2
Me(I) + nR – Cl → MeCl + 1/2nR – R ,
где R1 – S – R2 и nR – Cl углеводороды, содержащие серу и хлор.
Электрохимическая коррозия наиболее распространенный вид коррозии. Это разрушение деталей, машин, конструкций в грунтовых, речных, морских водах, под влиянием воды (росы), под воздействием смазочно-охлаждающих жидкостей, используемых при механической обработке металлов, атмосферная коррозия и т.д.
Электрохимическая коррозия – это пространственно разделенный окислительно-восстановительный процесс разрушения металла, протекающий в среде электролита, с возникновением внутри системы электрического тока, называемого коррозионным током.
Рассмотрим химизм атмосферной коррозии стального изделия. Сталь – это сплав железа с углеродом, в котором углерода менее 2%, например, цементит (Fe3C4). При электрохимической коррозии во влажном воздухе (О2 + 2Н2О) железо и цементит образуют микрогальванопару, в которой роль анода выполняет железо, а цементит – роль катода.
Схема процесса:
(А) Fe │H2O, O2 │ Fe3C4 (K)

Анодный процесс: Fe0 - 2ē → Fe2+ 2 поляризация
Катодный процесс: 2H2O + O2 + 4ē → 4OH- 1 деполяризация

Суммарное уравнение коррозионного процесса разрушения стального изделия, находящегося во влажном воздухе:
2Fe + 2H2O + O2 → 2Fe(OH)2
Для железа более характерна степень окисления (3+), поэтому процесс окисления идет дальше:
4Fe(OH)2+2H2O+O2→4Fe(OH)3,
образующийся Fe(OH)3 при нагревании может терять воду.
Fe (OH)3 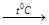 H2O + FeOOH.
H2O + FeOOH.
То есть продуктами коррозии железа (ржавчина) является смесь различных соединений. Если учесть, что в воздухе присутствуют углекислый газ, сернистый газ, следовательно, могут образовываться и соли железа.
 Часто из-за различной рельефности металлических конструкций, в том числе и стальных, на некоторых участках скапливается вода, при этом происходит так называемая концентрационная коррозия, обусловленная различной концентрацией деполяризатора кислорода (в случае атмосферной коррозии), водорода (в кислой среде) на различных участках металла. Там, где концентрация деполяризатора больше (края капли воды), формируется катодный участок, где концентрация деполяризатора меньше (центр капли воды) – анодный участок (рис.15).
Часто из-за различной рельефности металлических конструкций, в том числе и стальных, на некоторых участках скапливается вода, при этом происходит так называемая концентрационная коррозия, обусловленная различной концентрацией деполяризатора кислорода (в случае атмосферной коррозии), водорода (в кислой среде) на различных участках металла. Там, где концентрация деполяризатора больше (края капли воды), формируется катодный участок, где концентрация деполяризатора меньше (центр капли воды) – анодный участок (рис.15).
После высыхания капли в её центре обнаруживается углубление, а иногда даже и отверстие (для пластин толщиной 0,1 …0,2 мм). Такие процессы часто наблюдаются при атмосферной и почвенной коррозии железных и стальных изделий (троса, стопки листов и т.д.) – точечная коррозия, переходящая в питтинг. Следует отметить, что хотя конечный продукт коррозии (ржавчина) нерастворим, однако он не препятствует процессу растворения металла, поскольку формируется за пределами анодного участка (на границе соприкосновения его с катодами) в виде кольца внутри капли.
На практике часто встречаются случаи, когда металлы различной активности находятся в контакте друг с другом, образуя гальванопары. Кроме того, технические металлы содержат примеси других металлов, сплавы содержат различные металлы. Такой металл или сплав, находясь в среде электролита, дает множество микро - и макрогальванопар, в которых анодом является более активный металл, т.е. металл с меньшим значением электродного потенциала, именно он и подвергается коррозии.
Рассмотрим случай контактной коррозии с водородной деполяризациейцинка и меди, в сернокислой среде. Цинк и медь, имеют различные значения электродных потенциалов. Более активным в этой гальвано паре является цинк (Е0Zn2+/Zn = -0,76 В), он имеет меньшее значение электродного потенциала и будет анодом, т. е именно цинк будет подвергаться коррозионным процессам, менее активным металлом является медь (Е0Cu2+/Cu = +0,34 В), она будет катодом.
Запишем схему: (А) Zn │ H2SO4 │ Cu (K)
Анодный процесс: Zn0 - 2ē → Zn2+
+
Катодный процесс: 2Н+ + 2ē → Н2 деполяризатор

Суммарное ионное уравнение: Zn + 2H+ → Zn2+ + H2
Молекулярное уравнение: Zn + H2SO4 → ZnSO4 + H2.
Факторы, влияющие на скорость коррозии:
а) напряжение и деформация при механической обработке металлов;
б) перемешивание агрессивной среды;
в) дифференциальная аэрация;
г) температура;
д) кислотность среды (рН).
Рассматривая фактор (д) обратите внимание, что электродные потенциалы металлов существенно зависят от состава электролита и рН среды. Так, в случае контактной (Al-Zn) коррозии в 1М растворе HCl
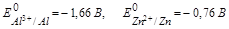 ,
,
возникает гальвано пара, в которой роль анода выполняет Al, а катода- Zn, схема такого процесса: (А) Al │ HCl │ Zn (K)
1моль/л
В 0,1 М растворе HCl 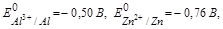 в этом случае большую активность имеет цинк, он будет в гальвано паре анодом, алюминий – катодом, а схему запишем так: (А) Zn │ HCl │ Al (K)
в этом случае большую активность имеет цинк, он будет в гальвано паре анодом, алюминий – катодом, а схему запишем так: (А) Zn │ HCl │ Al (K)
0,1моль/л
Электрокоррозия – протекает под действием блуждающих токов, возникает от постоянных источников тока (электротранспорт, трансформаторы, линии электропередач). Рассматривая коррозию под действием блуждающих токов, надо помнить, что место выхода тока – будет анодным участком, входа тока – катодным, участок протекания тока – нейтральной зоной. Радиус действия блуждающих токов может достигать нескольких десятков километров. Ток силой 1А за год разрушает до 3 кг алюминия, 9 кг железа, 11 кг цинка или меди, 34 кг свинца.
ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
Потери от коррозии в мировой экономике огромны. Около 1/3 вводимого в эксплуатацию металла подвергается коррозии, при этом примерно 10% теряется безвозвратно.
Борьба с коррозией осуществляется различными методами. Наиболее рациональный и надежный путь – изготовление аппаратов и машин изкоррозионно-стойких металлических или неметаллических материалов,но из-за дороговизны таких материалов, чаще используют дешевые и доступные металлы с последующей защитой их от коррозии. Полностью избежать коррозии невозможно, но, применив определенные методы защиты, можно снизить ее воздействие.
Можно условно выделить следующие группы методов защиты металлов от коррозии:
1.Создание рациональных конструкций, т.е. таких, которые не имеют застойных зон и других мест скопления влаги, грязи и других коррозионно-агрессивных сред, допускают быструю очистку и аэрацию.
2.Легирование металлов. Это эффективный, хотя обычно дорогой метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты (Cr, Ni, W, Si, V, Mo, Re и другие), вызывающие пассивирование металла. Механизм защиты (например, в нержавеющих сталях) состоит в образовании на поверхности плотных оксидных слоев, типа шпинелей состава NiO . Cr2O, FeO . Cr2O3, которые оказываются более устойчивыми, чем просто оксиды хрома или никеля.
3.Создание аморфных структур металлов. Путь к этому способу защиты открыла сверхбыстрая закалка. Расплавленный металл из тигля подают в тончайший зазор между двумя массивными валками и подвергают формированию и резкому охлаждению. В этих условиях атомы не успевают выстраиваться в присущие металлам кристаллические решетки, фиксируется «хаос атомов», свойственный расплавленному металлу. В результате получается аморфная структура, подобная стеклу, резко возрастает коррозионная устойчивость металлов.
4.Защитные покрытия – самый распространенный метод защиты металлов от коррозии. Смысл их нанесения – изоляция от агрессивной среды. Различают неметаллические и металлические покрытия.
а) неметаллические покрытия получают нанесением на поверхность металла лака, краски, смолы, олифы, эмали или стеклоэмали. Поверхность металла покрывают также резиной, эбонитом, полимерными материалами, цементом, бетоном, оксидными пленками: ZnO, Al2O3 (оксидирование) и нитридными пленками: Fe4N, Fe2N (азотирование). Покрыть поверхность металла можно осаждением нерастворимых фосфатов этого металла: Fe(H2PO4)2 + 2 Fe2+ ® Fe3(PO4)2¯ + 4H (фосфатирование) или насыщением поверхности металла углеродом (цементация).
б) защитные покрытия металлами. Для этого используют коррозионно-устойчивые металлы (Sn, Zn, Al, Au, Ag, Ni, Cr и др.) Различают анодные и катодные металлические покрытия. Если защищаемый металл покрывают более активным металлом, то такое покрытие называют анодным. При нарушении покрытия разрушается металл покрытия. Рассмотрим это на примере оцинкованного железа. Составим схему коррозионного разрушения.
( - ) (+)
(А) Zn │ H2O, O2 │ Fe (K)
 A: Zn0 - 2ē → Zn2+ 2
A: Zn0 - 2ē → Zn2+ 2
+
K: 2H2O + O2 + 4ē → 4OH- 1

2Zn + 2H2O + O2 → 2Zn(OH)2
Если защищаемый металл покрыт менее активным металлом, например, железо покрыто оловом, то такой вид покрытия называется катодным. При нарушении покрытия разрушается основной металл. Рассмотрим этот случай коррозии.
( - ) (+)
(А) Fe │ 2H+ │ Sn (K)
 A: Fe0 - 2ē → Fe2+ 1
A: Fe0 - 2ē → Fe2+ 1
+
 K: 2H+ + 2ē → H2↑ 1
K: 2H+ + 2ē → H2↑ 1
Fe + 2H+ → Fe2+ + H2
5. Электрохимические методы защиты:
а) защита внешним потенциалом);
б) анодная (протекторная).
Защита внешним потенциалом (чаще катодная) осуществляется подключением защищаемой конструкции к отрицательному полюсу (катоду) внешнего источника тока с очень малым напряжением (0,1 В). К положительному полюсу подсоединяется лом, который и разрушается. Этот вид защиты используют для металлических сооружений: трубопроводов, резервуаров и т.д.
Протекторная защитазаключается в том, что к изделию, подвергающемуся электрохимической коррозии, подключают деталь – протектор из более активного металла, чем металл изделия. Протектор будет разрушаться, а изделие останется неизменным. Применяют в паровых котлах, для защиты корпусов морских и речных судов, трубопроводов, рельсов и т.д.
Задача. Приведите пример протекторной защиты в электролите, содержащем растворенный кислород. Составьте уравнения анодного и катодного процессов и вычислите ЭДС реакции.
 Решение. Протекторная защита осуществляется путем присоединения к железу более активного металла, обычно цинка, магния и их сплавов. Таким образом, создается искусственный микрогальванический элемент. Чаще всего используют протекторную защиту в растворах электролитов (паровые котлы, химические аппараты), в морской воде и в почве (защита трубопроводов). Рассмотрим протекторную защиту от почвенной коррозии:
Решение. Протекторная защита осуществляется путем присоединения к железу более активного металла, обычно цинка, магния и их сплавов. Таким образом, создается искусственный микрогальванический элемент. Чаще всего используют протекторную защиту в растворах электролитов (паровые котлы, химические аппараты), в морской воде и в почве (защита трубопроводов). Рассмотрим протекторную защиту от почвенной коррозии:
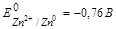
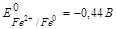
Среда нейтральная или слабощелочная, так как концентрация солей невелика. В этом, созданном нами, коррозионном элементе анодом служит протектор (цинк), он растворяется.
Анод: Zn0 – 2  ® Zn2+ .
® Zn2+ .
Электроны передаются на железо. Деполяризатором в этом случае является кислород.
Катод: O2 + 2H2O + 4  ® 4OH-; E0 = 0,40 B.
® 4OH-; E0 = 0,40 B.
Суммарная реакция: 2Zn0 + O2 + 2H2O = 2Zn(OH)2.
ЭДС реакции определяем: DЕ = Екатода – Еанода = 0,40 – (-0,75) = 1,16 В.
Ответ: протектор Zn, он окисляется и защищает железо; DЕ=1,16 В.
6. Воздействие на агрессивную среду. Для замедления коррозии в агрессивную среду вводят вещества, называемые ингибиторами (замедлителями). Это чаще всего органические вещества, пассивирующие поверхность металла: тиомочевина C(NH2)2S, диэтиламин C2H5— NH — C2H5, уротропин (CH2)6N4, неорганические вещества SiO32-, NO2-, Cr2O72-, а также освобождение воды от растворенного в ней кислорода (воду фильтруют через слой железных опилок). Либо удаляют активаторы коррозии, например, ионы Cl-, Br-, F-, SO42-, NO3-.
ЭЛЕКТРОЛИЗ.
План
1. Сущность процессов протекающих при электролизе.
2. Виды электролиза:
2.1 электролиз расплавов,
2.2 электролиз водных растворов.
3. Последовательность разрядки ионов на электродах.
4. Явление перенапряжения.
5. Законы электролиза.
6. Применение электролиза.
Литература.
1. Фролов В.В. Химия. Гл.V, §51-56.
2. Лучинский Г.П. Курс химии. Гл.V, §8-12, гл. VI, §13-18
3. Общая химия под ред. Соколовской Е.М. и др. Гл.6, §1-11.
Дата добавления: 2020-04-12; просмотров: 706;











