Фазовые превращения.
Теплота фазового перехода равна разности DН0обр вещества в одном и в другом состояниях. Для испарения воды (250С) имеем:
Н2О(ж)®Н2О(г) DН0обр. кДж/моль -285.8 -241.8
DНисп.= -241.8 + 285.8= +44 кДж/моль (эндотермический процесс).
ВТОРОЕ НАЧАЛО ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ.
План
1. Понятие термодинамической вероятности.
2. Энтропия.
3. Формулировки II закона термодинамики.
4. Энергия Гельмгольца.
5. Энергия Гиббса.
Литература:
1. Фролов В.В. Химия. Гл.VI, §6.1 – 6.11.
2. Лучинский Г.П. Курс химии. Гл. IV, §1-7.
3. Ахметов Н.С. Общая и неорганическая химия. Раздел V, гл. 1,2.
4. Общая химия под ред. Соколовской Е.М. и др. Гл. 5, § 1-6.
Первый закон термодинамики, с которым вы познакомились при рассмотрении предыдущей лекции, по своей сущности является законом сохранения. Он позволяет рассчитывать энергетику процесса, однако не решает вопрос возможности протекания процесса и если процесс возможен, то о его направлении. Например, протекание таких процессов как самопроизвольное разделение газов или переход тепла от холодного тела к горячему невозможно, так как в природе все процессы протекают сами собой с определенной направленностью, т.е. самопроизвольно теплота может переходить от горячего тела к холодному и т.д., что является следствием молекулярной природы вещества. Однако, такие не реальные явления, как самопроизвольное разделение газов или переход тепла от холодного тела к горячему не противоречат первому закону термодинамики.
Рассмотрим одностороннее протекание процессов на примере выравнивания температур между частями системы. Это переход менее вероятного упорядоченного состояния (рис.7а): частицы с большей энергией (Т2; Т2 > Т1) находятся в одной части пространства, а частицы с меньшей энергией – в другой, в более вероятное состояние беспорядка (рис.7 б) (Т1=Т2=Тср).
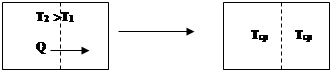 |
Рис. 7а Рис. 7 б
Или, например, допустим, что все молекулы вещества сосредоточены в небольшой части V1 объема V0 (рис.8а). Это означает наличие в системе высокой энергетической упорядоченности, так как молекулы являются носителями внутренней энергии. Из опыта известно, что такой порядок неустойчив, менее вероятен: частицы (если они ничем не зафиксированы) стремятся занять весь объем V0 (рис.8б). В результате в системе повышается степень энергетического беспорядка, т.е. состояние системы (рис.8б) более вероятно.
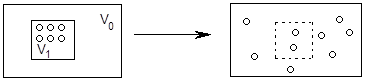 |
Рис. 8а Рис.8б
Для характеристики более вероятных процессов (рис.7б; 8б) в термодинамике используют понятие – термодинамическая вероятность, W.Термодинамическая вероятность, W – это количество микросостояний системы.
Дата добавления: 2020-04-12; просмотров: 717;











