ХИМИЧЕСКАЯ КИНЕТИКА.
План
1. Гомогенные и гетерогенные химические процессы.
2. Факторы, влияющие на скорость химических реакций.
2.1 природа реагирующих веществ;
2.2 концентрация (давление). Закон действия масс.
2.3 температура. Правило Вант-Гоффа. Уравнение Аррениуса.
Энергия активации.
2.4 катализатор.
3. Химическое равновесие. Константа равновесия.
4. Смещение равновесия. Принцип Ле-Шателье.
Литература:
1. Фролов В.В. Химия. Гл.V, §51-56.
2. Лучинский Г.П. Курс химии. Гл.V, §8-12, гл. VI, §13-18
3. Ахметов Н.С. Общая и неорганическая химия. Раздел V, гл.3,4.
4. Общая химия под ред. Соколовской Е.М. и др. Гл.6, §1-11.
Химическая термодинамика изучает возможность, направление и пределы самопроизвольного протекания химических процессов. Однако механизм и скорость процессов в химической термодинамике не рассматриваются. В то же время представление о скорости химических реакций и факторах, влияющих на нее, исключительно важно для управления химическими процессами. Область химии, изучающая механизм химических реакций и скорость их протекания, называется химической кинетикой.
Химические реакции могут протекать с различными скоростями. Одни из них протекают мгновенно: 2H2 + O2 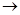 2H2O , другие протекают в течение нескольких секунд, минут:CuSO4 + 2NaOH
2H2O , другие протекают в течение нескольких секунд, минут:CuSO4 + 2NaOH 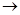 Na2SO4+Cu(OH)2, FeCl3 + 3NaOH
Na2SO4+Cu(OH)2, FeCl3 + 3NaOH 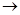 3NaCl+Fe(OH)3 .
3NaCl+Fe(OH)3 .
Биологические реакции могут длиться годы, десятилетия, а превращение древесины в уголь происходит в течение столетий, тысячелетий. При изучении скорости химических реакций необходимо различать гомогенные и гетерогенные реакции.
Гомогенные реакции– это такие реакции, в которых исходные вещества и продукты находятся в одинаковых агрегатных состояниях: газообразном (г) или жидком (ж), или твердом (т) и не имеют между собой поверхности раздела.
Гетерогенные реакции – это такие реакции, в которых исходные вещества и продукты реакции имеют между собой поверхность раздела и находятся в различных агрегатных состояниях.
В химической кинетике различают мгновенную (или истинную) скорость и среднюю скорость.
Мгновенная скорость химической реакции определяется первой производной концентрации по времени.
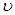 мгн
мгн 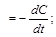 С - концентрация реагирующих веществ (моль/л);
С - концентрация реагирующих веществ (моль/л);
t –время реакции, с.
Средняя скорость реакции 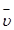 равна изменению концентрации (DС) реагирующих веществ за определенный промежуток времени (Dt):
равна изменению концентрации (DС) реагирующих веществ за определенный промежуток времени (Dt):
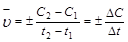
Размерность скорости реакции моль/л .с.
Скорость гомогенной реакции определяется как количество вещества (n) вступившего в реакцию или образовавшегося в результате химической реакции за единицу времени в единице объема:
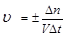 ; n – число молей участвующих в реакции;
; n – число молей участвующих в реакции;
V – объем (л);
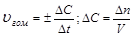 - молярная концентрация (моль/л).
- молярная концентрация (моль/л).
Скорость гетерогенной реакции – это количество вещества вступившего в реакцию или образовавшегося в результате ее за единицу времени на единице площади поверхности фазы:
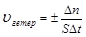 ;
; 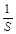 - единица площади поверхности фазы.
- единица площади поверхности фазы.
Факторы, влияющие на скорость химической реакции:
Дата добавления: 2020-04-12; просмотров: 620;











