Окислительно-восстановительное титрование
Методы окислительно-восстановительного титрования основаны на использовании реакций, связанных с переносом электронов, то есть окислительно-восстановительных процессов.
Реакции окисления-восстановления – это реакции, в которых реагирующие вещества присоединяют или отдают электроны. Окислителем называется частица (ион, молекула, элемент), которая присоединяет электроны и переходит при этом из более высокой степени окисления в более низкую, т.е. восстанавливается. Восстановитель – это частица, которая отдает электроны и переходит при этом из более низкой степени окисления в более высокую, т.е. окисляется.
2КМnО4 +10FeSО4 +8Н2SО4↔2МnSО4 + 5Fe2(SО4)3+К2SО4 + 8Н2О
Fe 2+ - е ↔ Fe 3+
МnО4 - + 5е + 8Н + ↔ Мn 2+ + 4Н2О
Методы окислительно-восстановительного титрования пригодны для определения многих органических соединений, в том числе фармацевтических препаратов, подавляющее большинство которых являются потенциальными восстаноометриювителями.
В зависимости от используемого титранта различают перманганатометрию, йодометрию, дихроматометрию, броматометрию. В этих методах в качестве стандартных растворов применяют соответственно KMnO4, I2, K2Cr2O7, KBrO3 и т.д.
Из всех типов химических реакций, используемых в количественном анализе, окислительно-воостановительные реакции (ОВР) являются наиболее сложными по механизму.
Отличительным признаком ОВР является перенос электронов между реагирующими частицами, в результате чего степень окисления реагирующих частиц изменяется.
При этом одновременно происходят два процесса – окисление одних и восстановление других. Таким образом, любая ОВР, записанная в общем виде
aOx1 + bRed2 = aRed1 + bOx2
Может быть представлена в виде двух полуреакций:
Ox1 + b 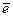 = Red1
= Red1
Red2 – а 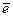 = Ox2
= Ox2
Исходная частица и продукт каждой полуреакции составляют ОВ пару. Например, в реакции окисления железа(II) перманганатом калия участвуют две ОВ пары: Fe3/Fe2+ и MnO4-/Mn2+.
В процессе титрования по методу окисления-восстановления происходит изменение ОВ потенциалов взаимодействующих систем. Если условия отличаются от стандартных, т.е. активности потенциалопределяющих ионов не равны 1 (а≠1), равновесный потенциал ОВ полуреакции aOx1 + n 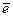 = bRed1 может быть рассчитан по уравнению Нернста:
= bRed1 может быть рассчитан по уравнению Нернста:
EOx1/ Red1 = Eº + 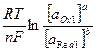 ,
,
R – универсальная газовая константа (8,314 Дж/моль∙град., F – постоянная Фарадея (9,6585 кл/моль), Е – ОВ потенциал системы, Еº - стандартный ОВ потенциал.
Если подставить значения постоянных величин, Т = 298 К (т.е. 25 ºС) и заменить натуральный логарифм на десятичный, а активности – на концентрации, то уравнение Нернста примет следующий вид:
EOx1/ Red1 = Eº + 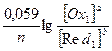 .
.
Окислительно-восстановительные реакции (ОВР) протекают сложнее, чем ионообменные и имеют следующие особенности:
1. Потенциал системы зависит от величины стандартного ОВ потенциала системы, концентраций окислителя и восстановителя, концентрации ионов водорода и от температуры.
2. Реакции часто проходят в несколько стадий, причем каждая из них протекает с различной скоростью.
3. Скорость ОВР ниже скорости реакций ионного обмена. Часто требуются особые условия, обеспечивающие протекание реакций до конца.
4. Присутствие осадителей или комплексообразователей, вызывая изменение концентраций окисленной или восстановленной форм, приводит к изменению ОВ потенциала системы.
Реакции окисления-восстановления, на основе которых осуществляется титрование, должны удовлетворять всем требованиям, предъявляемым к реакциям при титровании. Для повышения скорости ОВР используют различные приемы: повышают температуру, концентрации реагирующих веществ, изменяют pH раствора или вводят катализатор.
Точку эквивалентности фиксируют чаще всего с помощью Red/Ox – индикаторов, т.е. органических соединений, которые изменяют свою окраску в зависимости от потенциала системы. При избытке окислителя образуется окисленная форма индикатора, а избыток восстановителя приводит к образованию его восстановленной формы. Процесс перехода окисленной формы в восстановленную и обратно, сопровождающийся изменением окраски, можно повторять много раз без разрушения индикатора. К таким индикаторам относят дифениламин (в окисленном состоянии сине-фиолетовый, а в восстановленном – бесцветный) и N-фенилантраниловая кислота (окисленная форма – красная, восстановленная – бесцветная).
Для некоторых реакций используют специфические индикаторы – вещества, изменяющиеся окраску при реакции с одним из компонентов титрования. Например, таким индикатором является крахмал, образующий с йодом адсорбционное соединение синего цвета.
В некоторых случаях используют титрование без индикатора, если окраска титранта достаточно яркая и резко изменяется в результате реакции. Примером может служить титрование с помощью перманганата калия (KMnO4), малиновый раствор которого при восстановлении MnO4- в Mn2+ обесцвечивается. Когда все титруемое вещество прореагирует, лишняя капля раствора KMnO4 окрасит раствор в бледно-розовый цвет.
Перманганатометрия
В сильнокислой среде перманганат-ионы обладают высоким окислительно-восстановительным потенциалом, восстанавливаясь до Mn(II). Поэтому KMnO4 применяют для определения многих восстановителей: Fe(II), H2O2, NO2-, Sb(III), органических кислот. Используя метод заместительного титрования, определяют катионы, образующие малорастворимые оксалаты (Ca2+, Zn2+, Co2+ и др.).
В зависимости от кислотности растворов реакция восстановления перманганат-иона протекает различно. В кислой среде реакция протекает по уравнению
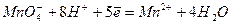 (
( 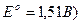 ;
;
в слабощелочной или нейтральной средах:
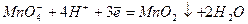

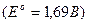 ;
;
В щелочной среде:
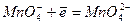
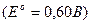
Все прямые определения восстановителей обычно проводят в сернокислой среде (0,05 М H2SO4 и выше) при 70 - 80º С. Для того чтобы в процессе титрования сохранялась высокая температура, объем титруемого раствора берут больше обычного: ~ 150 мл.
При титровании перманганатом калия, как правило, не применяют индикаторы, так как реагент сам окрашен и является чувствительным индикатором: 0,1 мл 0,01 М раствора KMnO4 окрашивает 100 мл воды в бледно-розовый цвет.
Дата добавления: 2017-04-05; просмотров: 3724;











