БУФЕРНЫЕ СИСТЕМЫ. ИЗУЧЕНИЕ СВОЙСТВ БУФЕРНЫХ И НЕБУФЕРНЫХ СИСТЕМ.ОПРЕДЕЛЕНИЕ БУФЕРНОЙ ЕМКОСТИ РАСТВОРА.ОПРЕДЕЛЕНИЕ рН ПОТЕНЦИОМЕТРИЧЕСКИМ МЕТОДОМ В БИОЛОГИЧЕСКИХ ОБЪЕКТАХ.
Вода – основа жизни на Земле. Она играет исключительно важную роль в биохимических процессах, являясь основной составной частью (от 58 до 97 %) всех клеток и тканей человека, животных, растений и простейших организмов. Вода – это среда, в которой протекают самые разнообразные биохимические процессы.
Вода обладает хорошей растворяющей способностью и вызывает электролитическую диссоциацию многих растворенных в ней веществ.
Вода является слабым электролитом и диссоциирует на катионы водорода и анионы гидроксила по уравнению:
Н2О Û Н+ + ОН-
Согласно закону действующих масс константа диссоциации воды будет равна:
К = 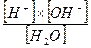
Диссоциация воды очень мала (при 25°С она равна 1.8 10-9), поэтому знаменатель в приведенном уравнении можно считать практически постоянным, и соотношение можно записать следующем образом:
[Н+ ] × [ОН-] =К ×[Н2О] = Кw = 10 -14
где Кw – ионное произведение воды. Таким образом, произведение концентрации ионов водорода и ионов гидроксилав любом водном растворе есть величина постоянная, называемая ионным произведением воды
Так как компоненты рассматриваемой системы сопряжены, то увеличение концентрации одного иона неизбежно связано с уменьшением концентрации другого. При этом из водного раствора не могут совершенно исчезнуть ни водородные, ни гидроксильные ионы. И при любой их концентрации ионное произведение останется постоянным – 10-14.
Концентрация ионов водорода в растворах представляет важный физико-химический фактор, определение ее имеет большое значение при изучении самых разнообразных физических, химических и биологических процессов.
В природных растворах и биологических жидкостях, которые количественно характеризуются как разбавленные растворы (С £ 0,1 М), активность ионов водорода колеблется примерно в пределах 10-3 £ С £ 10-9М, т.е. она очень мала и для практической работы ее удобно выражать через отрицательный десятичный логарифм активности и обозначать рН:
рН = -lg аН+
Таким образом, водородным показателем – рН – называют величину, численно равную отрицательному десятичному логарифму активности (концентрации) ионов водорода. Логарифмируя ионное произведение воды, получаем:
рН + рОН = 14
В разбавленных водных растворах 0£ рН £14, 0£ рН £7 – в кислых растворах, рН = 7 – в нейтральных и 7 £ рН £14 – в щелочных растворах.
Уравнения для расчета рН в разбавленных растворах различных классов соединений приведены ниже:
Сильные кислоты: рН = - lg aH+.
Сильные основания: pH = 14 – pOH.
Слабые кислоты: pH = ½ (pKк – lgC).
Слабые основания: pH = 14 – 1/2pKо + ½ lgC.
Гидролитически кислые соли: pH = 7 –1/2pKосн – 1/2lgC.
Гидролитически щелочные соли: pH = 7 + 1/2pKкисл + 1/2lgC.
Буферные растворы: pH = pKa + lg[соль] – lg[кислота].
рH = pKa + lg[основание] - lg[соль].
Буферные системы
Одним из характерных свойств внутренней системы организмов является постоянство концентрации водородных ионов (изогидрия). Так, например, рН крови человека – 7,36. Сохранение этого показателя обеспечивается совместным действием ряда физико-химических и физиологических механизмов, из которых очень важная роль принадлежит буферным системам.
Буферными системами называются растворы, обладающие свойством достаточно стойко сохранять постоянство концентрации водородных ионов как при добавлении к ним небольшого количества сильных кислот или щелочей, так и при разведении.
Буферные системы (смеси или растворы) по составу бывают двух основных типов:
а) кислотные - слабая кислота и ее соль, образованная этой кислотой с сильным основанием;
б) основные - слабое основание и его соль, образованная этим основанием и сильной кислотой.
На практике часто применяются следующие буферные смеси:
СН3 СООН
СН3СООNa - ацетатный буфер;
Н2СО3
NaHCO3 - бикарбонатный буфер;
NH4OH
NH4Cl - аммиачный буфер
КН2PO4
Na2HPO4 - фосфатный буфер
Pt – COOH – белок-кислота
Pt – COONa – белок-соль - белковый буфер (Pt – протеин-белок).
Каждая из буферных смесей характеризуется определенной концентрацией водородных ионов, которую буферная система и стремится сохранить при добавлении кислот или щелочей. Рассмотрим, что определяет постоянство рН, например, ацетатной буферной смеси
СН3СООН Û Н+ + СН3СОО -
СН3СООNa ÞСН3СОО- + Na+
В ацетатном буферном растворе концентрация водородных ионов будет зависеть от степени диссоциации молекул кислоты. Согласно закону действия масс, константа диссоциации уксусной кислоты будет:
К = 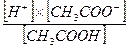 , откуда
, откуда
[H+ ] = К× 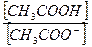
При добавлении к слабодиссоциированной уксусной кислоте (К = 1,86× 10-5) ее сильнодиссоциированной соли происходит резкое увеличение концентрации общего аниона (СН3СОО -). В соответствие с законом действия масс это вызывает смещение равновесия влево, т.е. приводит к увеличению недиссоциированных молекул кислоты:
СН3СООН Ü СН3СОО - + Н+
Слабая диссоциация уксусной кислоты еще в большей степени будет подавлена и концентрация недиссоциированных молекул кислоты может быть принята равной общей концентрации кислоты. Так как соль полностью диссоциированна на ионы, то общая концентрация анионов может быть принята за общую концентрацию соли в буферном растворе. Исходя из этого, концентрацию ионов водорода в буферной смеси можно представить в следующем виде:
[H+ ] = Кк× 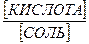
Для основного буфера, каким является, например аммиачный, соответственно будет
[OH -] = Ко× 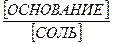
Данные выражения являются основным уравнением буферных растворов. В логарифмической форме эти уравнения принимают вид:
pH = pKк + lg[соль] – lg[кислота].
рH = pKо + lg[основание] - lg[соль].
Таким образом, рН буферных смесей зависит от константы диссоциации кислоты или основания и от соотношения концентрации компонентов буферных смесей. Используя основное уравнение буферного раствора, можно вычислить рН любого буферного раствора, зная константу электролитической диссоциации кислоты или основания и концентрации кислоты и соли, а при одинаковых концентрациях их объемные отношения.
Предел, в котором проявляется буферное действие буферной системы характеризуется буферной емкостью. Численное значение буферной емкости (Б) определяется числом моль сильной кислоты или сильного основания, которое необходимо добавить к 1 л буферной смеси, чтобы изменить значение рН на 1:
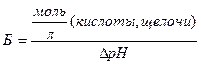 ,
,
где: DрН – изменение рН при титровании буфера кислотой или щелочью, наиболее близкое к 1 (DрН = рН1 – рН0).
Дата добавления: 2016-09-26; просмотров: 4232;











