Примеры решения задач. Рассчитать изменение энтропии при смешении
Задача 1.
Рассчитать изменение энтропии при смешении 200 м3 азота при 700 К и 500 м3 гелия при Т = 300 К при Р = I атм.
Дано:
V(N2) = 200 м3 ; V(He) = 500 м3 ;
Т (N2) = 700 К; Т (He) = 300 К
Р = 1 атм
DS = ?
Решение:Расчет DS смешения производится по уравнению
DS = - R 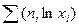 .
.
Это уравнение можно использовать, если давление и температура обоих газов одинаковы. В данном случае давления равны, а температура при смешении газов будет выравниваться, поэтому необходимо найти температуру смеси Тх. При смешении температура азота уменьшается, то есть азот передает какое-то количество теплоты гелию, а гелий принимает эту теплоту и повышает свою температуру. По абсолютной величине количество теплоты одно и то же, но знаки разные, поэтому, чтобы составить уравнение теплового баланса, следует одну из теплот взять с обратным знаком, то есть Q (N2) = - Q (Не)
Примем Ср = const и рассчитаем по классической теории. Молярная теплоемкость для двухатомных газов Ср = 7/2 R , для одноатомных Ср = 5/2 R, Дж/моль·К; R = 8,31 Дж/моль·К;
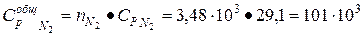 Дж/К
Дж/К
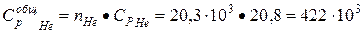 Дж/К
Дж/К
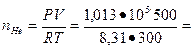 20,3•103 моль
20,3•103 моль
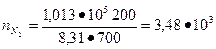 моль
моль
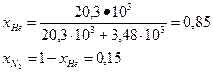
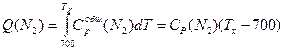
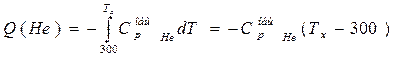
101.103(Tx-700) = -422•103(Tx-300)
Tx= 377 К
При выравнивании температур произошло изменение энтропии азота и гелия
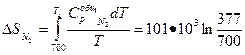 = -62,5•.103 Дж/К
= -62,5•.103 Дж/К
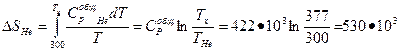 Дж/К
Дж/К
Теперь рассчитываем изменение энтропии при смешении
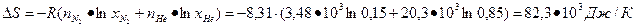
Общее изменение энтропии системы равно сумме изменений энтропии всех стадий процесса
DS = -62,5•103 +530•103 + 82,3•103 = 549•103 Дж/К
Задача 2.
Рассчитать DS реакции 2 S02 + 02 = 2 S03 при стандартных условиях. Можно ли сделать вывод о возможности окисления S02 кислородом в этих условиях?
Решение:
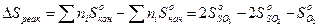
Значения абсолютных энтропии берем из справочника 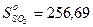 Дж/моль.К;
Дж/моль.К;
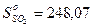 Дж/моль.К;
Дж/моль.К; 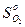 =205,04 Дж/моль.К
=205,04 Дж/моль.К
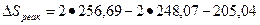 . = - 187,8 Дж/К
. = - 187,8 Дж/К
Полученное значение нельзя использовать для определения возможности процесса, так как реакция идет при стандартных условиях, то есть при Р и Т = const, а не в изолированной системе.
При Р и Т = const следует рассчитать значение 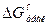 .
.
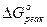 =
= 

Поскольку изменение энергии Гиббса меньше нуля, следовательно, реакция в прямом направлении пойдет.
Дата добавления: 2016-06-22; просмотров: 2357;











