Применение первого закона термодинамики к изопроцессам
Напомним, что в изопроцессе остаётся неизменным значение некоторой величины, характеризующей состояние газа — температуры, объёма или давления. Для каждого вида изопроцессов запись первого закона термодинамики упрощается.
Изотермический процесс, T = const.
Внутренняя энергия идеального газа зависит только от его температуры. Если температура газа не меняется, то не меняется и внутренняя энергия: ∆U = 0. Тогда формула (2) даёт:
Q = A.
Всё подведённое к газу тепло идёт на совершение газом работы.
Изохорный процесс, V = const.
Если объём газа остаётся постоянным, то поршень не перемещается, и потому работа газа равна нулю: A = 0. Тогда первый закон термодинамики даёт:
Q = ∆U.
Всё тепло, переданное газу, идёт на изменение его внутренней энергии.
Изобарный процесс, p = const.
Подведённое к газу тепло идёт как на изменение внутренней энергии, так и на совершение работы. Имеем:
Q = ∆U + p∆V.
Адиабатный процесс
Процесс называется адиабатным, если он идёт без теплообмена с окружающими телами.
Адиабатный процесс совершается газом, находящимся в теплоизолированном сосуде. Такой сосуд препятствует всем видам теплопередачи: теплопроводности, конвекции, излучению. Пример теплоизолированного сосуда — термос.
Приблизительно адиабатным будет всякий процесс, протекающий достаточно быстро: в течение процесса теплообмен просто не успевает произойти.
При адиабатном процессе Q = 0. Из первого закона термодинамики получаем: A + ∆U = 0, или A = −∆U.
В процессе адиабатного расширения газ совершает положительную работу, поэтому ∆U <0 (работа совершается за счёт убыли внутренней энергии). Следовательно, газ охлаждается. Если заставить газ совершить достаточно большую работу, охладить его можно весьма сильно. Именно на этом основаны методы сжижения газов.
Наоборот, в процессе адиабатного сжатия будет A <0, поэтому ∆U >0: газ нагревается. Адиабатное нагревание воздуха используется в дизельных двигателях для воспламенения топлива.
Кривая, изображающая ход адиабатного процесса, называется адиабатой. Интересно сравнить ход адиабаты и изотермы на pV-диаграмме.
| p |
| изотерма |
| адиабата |
V
Сравнительный ход изотермы и адиабаты
В обоих процессах давление убывает с увеличением объёма, но в адиабатном процессе убывание идёт быстрее. Почему?
При изотермическом расширении давление падает потому, что уменьшается концентрация частиц газа, в результате чего удары частиц по стенкам сосуда становятся реже. Однако интенсивность этих ударов остаётся прежней: ведь температура газа не меняется — значит, не меняется и средняя кинетическая энергия его частиц.
А при адиабатном расширении, наряду с уменьшением концентрации частиц, падает также и температура газа. Удары частиц становятся не только более редкими, но и более слабыми. Вот почему адиабата убывает быстрее изотермы.
Решение задач
Задача №1
При изохорном процессе углероду массой 600 грамм было передано 80 КДж тепла. На сколько при этом изменится его температура?
Дано: CИ: Решение:
Q=80 КДж 80*103Дж Q=∆U
M=600 гр 0,6 кг Q=  =>∆Т=
=>∆Т= 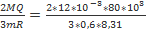 =128 K
=128 K
∆Т-? Ответ:128 К
Задача №2
При адиабатном процессе объем газа изменился на 6 литров, его внутренняя энергия изменилась на 36 кДж. Какое давление при этом оказывает газ на стенки сосуда?
Дано: СИ: Решение:
∆V=6л 6*10-3м3 ∆U=А1=p∆V =>p= 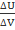
∆U=36 кДж 36*103Дж p= 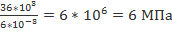
p-? Ответ:6 МПа
Задача №3
Какую работу совершает кислород массой 320 грамм при изобарном нагревании на 10 К?
Дано: CИ: Решение:
m=320г 0,32кг А1=p∆V= 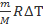
∆Т=10 К А1= 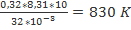
А1-? Ответ:830 К
Дата добавления: 2020-04-12; просмотров: 765;











