Взаимодействие частиц вещества
Третье положение МКТ говорит о взаимодействии частиц вещества: атомы или молекулы взаимодействуют друг с другом силами притяжения и отталкивания, которые зависят от расстояний между частицами: при увеличении расстояний начинают преобладать силы притяжения, при уменьшении — силы отталкивания.
О справедливости третьего положения МКТ свидетельствуют силы упругости, возникающие при деформациях тел. При растяжении тела увеличиваются расстояния между его частицами, и начинают преобладать силы притяжения частиц друг к другу. При сжатии тела расстояния между частицами уменьшаются, и в результате преобладают силы отталкивания. В обоих случаях упругая сила направлена в сторону, противоположную деформации.
Другим подтверждением существования сил межмолекулярного взаимодействия служит наличие трёх агрегатных состояний вещества.
В газах молекулы удалены друг от друга на расстояния, значительно превышающие размеры самих молекул (в воздухе при нормальных условиях — примерно в 1000 раз). На таких расстояниях силы взаимодействия между молекулами практически отсутствуют, поэтому газы занимают весь предоставленный им объём и легко сжимаются.
В жидкостях промежутки между молекулами сравнимы с размерами молекул. Силы молекулярного притяжения весьма ощутимы и обеспечивают сохранение жидкостями объёма. Но для сохранения жидкостями ещё и формы эти силы недостаточно велики — жидкости, как и газы, принимают форму сосуда.
В твёрдых телах силы притяжения между частицами очень велики: твёрдые тела сохраняют не только объём, но и форму.
Переход вещества из одного агрегатного состояния в другое является результатом изменения величины сил взаимодействия между частицами вещества. Сами частицы остаются при этом неизменными.
В предыдущем разделе, посвящённом основным положениям МКТ, мы вкратце описали молекулярное строение газов, жидкостей и твёрдых тел. Остановимся на этом вопросе подробнее.
Газы
Газы — самый простой объект для изучения в молекулярно-кинетической теории. Почему? Дело в том, что средние расстояния между частицами газов намного превышают размеры самих частиц. В промежутках между соударениями частицы газа проходят расстояния, на несколько порядков превышающие собственные размеры (рис. 3).
Рис. 3. Частицы газа
Например, в воздухе при нормальных условиях длина свободного пробега молекулы составляет примерно 10−5 см. Это на три порядка превышает средний размер молекулы (10−8 см).
При таких больших расстояниях между частицами силы межмолекулярного взаимодействия оказываются весьма незначительными. Во многих ситуациях взаимодействием частиц газа на расстоянии можно пренебречь и учитывать лишь их соударения друг с другом. Вот почему изучать газы гораздо проще, чем жидкости или твёрдые тела.
Не испытывая сильного притяжения со стороны других частиц, любая частица газа обладает полной свободой передвижения и может оказаться в любом месте сосуда. Поэтому газы не имеют ни фиксированной формы, ни фиксированного объёма. Мы можем поместить данную порцию газа в какой угодно сосуд, и газ неизменно займёт весь предоставленный ему объём. В зависимости от объёма сосуда будут изменяться лишь средние расстояния между частицами газа.
Способность газов менять свой объём находит широчайшее применение в технике. Функционирование тепловых двигателей и многих других устройств основано в конечном счёте на том, что газ при расширении перемещает поршень и совершает работу.
Твёрдые тела
Если сравнивать с газами, то твёрдые тела являются их полной противоположностью. Ни о какой свободе передвижения частицы твёрдых тел даже «не помышляют».
В твёрдых телах частицы расположены весьма близко друг к другу: расстояния между частицами порядка размера самих частиц. Силы взаимодействия между частицами твёрдого тела очень велики; расположение частиц в пространстве обладает периодической повторяемостью и образует так называемую кристаллическую решётку.
Например, на рис. 4 представлена пространственная модель кристаллической решётки кремния
. Шарики — это атомы кремния, а трубки между шариками изображают силы взаимодействия между атомами.
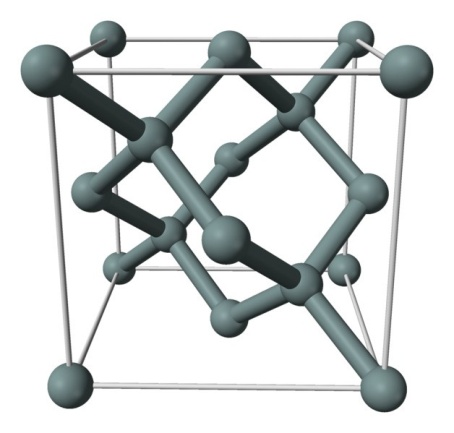
Рис. 4. Пространственная модель кристаллической решётки
Атомы кремния, как видите, расположены в пространстве периодическим образом, причём каждый атом сцеплен с четырьмя другими атомами. На рис. 5 мы видим плоское изображение той же самой кристаллической решётки (вдобавок показаны электроны, находящиеся на внешних оболочках атомов кремния).
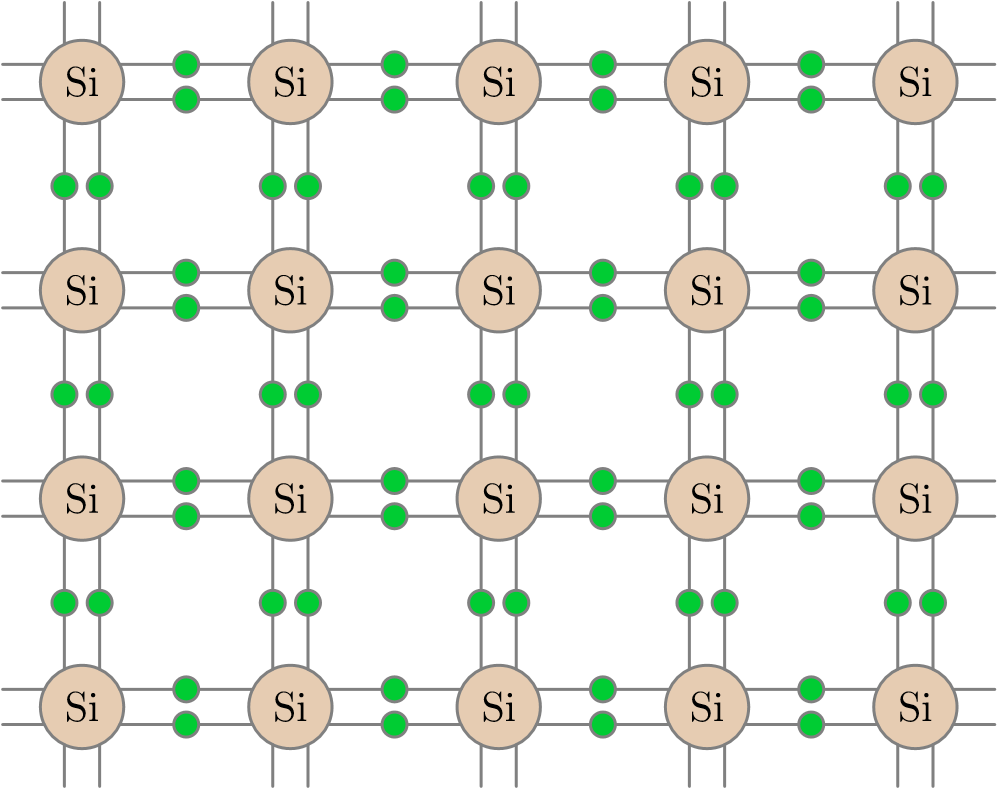
Рис. 5. Плоское изображение кристаллической решётки
Точки пространства, в которых находятся частицы твёрдого тела, называются узлами кристаллической решётки.
На самом деле частицы не покоятся в узлах кристаллической решётки, а совершают тепловое движение — колеблются относительно этих самых узлов. Таким образом, узел кристаллической решётки — это положение равновесия частицы, в небольшой окрестности которого частица постоянно находится. Чтобы покинуть область своего обитания (выскочить из узла), частице нужна очень большая энергия; произойти такое событие может лишь при чрезвычайно редком стечении обстоятельств. Имея столь жёсткую внутреннюю структуру, твёрдое тело сохраняет неизменными свою форму и свой объём.
Жидкости
По своим свойствам жидкости занимают промежуточное положение между газами и твёрдыми телами: жидкости сохраняют объём, но не форму. Мы можем говорить об одном литре воды, переливая её из сосуда в сосуд; но при этом вода принимает форму сосуда.
Как и в твёрдых телах, частицы жидкости упакованы весьма плотно и совершают колебания около некоторых положений равновесия. Попытка сжатия жидкости немедленно приводит к деформациям самих молекул и встречает мощное сопротивление: жидкости, в отличие от газов, практически не сжимаемы.
Однако, в отличие от твёрдых тел, частица жидкости не привязана навсегда к своему положению равновесия: спустя некоторое время она скачком меняет его на новое положение и колеблется в окружении новых частиц. Затем — новый скачок, новый период «осёдлой жизни», и так далее (рис. 6). Если частицы твёрдых тел можно сравнить с людьми, имеющими свой дом, то частицы жидкостей — это кочевники, постоянно меняющие места своих стоянок.
Рис. 6. «Осёдло-кочевая жизнь» молекулы жидкости
На рисунке мы видим молекулу жидкости, время от времени меняющую место своего расположения. «Ореол», окружающий молекулу, изображает область осёдлой жизни, внутри которой молекула совершает тепловые колебания. Теоретические расчёты показывают, что за время осёдлой жизни молекула совершает несколько десятков-сотен колебаний внутри области осёдлой жизни.
Силы притяжения между частицами жидкости достаточно велики для того, чтобы объём сохранялся фиксированным. Но ограниченность времени осёдлой жизни частиц придаёт жидкостям текучесть: жидкости не сохраняют форму.
Рассмотрим для примера воду в стакане. Скачки молекул из одного осёдлого положения в другое происходят равновероятно по всем направлениям. Но если стакан наклонить, то в определённых участках воды сила тяжести задаст преимущественное направление этих скачков, и форма воды в стакане поменяется. Таково в общих чертах объяснение текучести.
Введём основные величины молекулярной физики и соотношения между ними.
m — масса вещества, V — объём вещества, 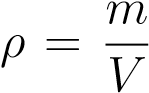 — плотность вещества (масса единицы объёма). Отсюда
— плотность вещества (масса единицы объёма). Отсюда
m = ρV.
N — число частиц вещества (атомов или молекул). m0 — масса частицы вещества. Тогда
m = m0N.
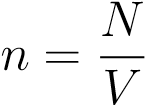 — концентрация вещества (число частиц в единице объёма), [n] = м−3. Отсюда
— концентрация вещества (число частиц в единице объёма), [n] = м−3. Отсюда
N = nV.
Что получится, если m0 умножить на n? Произведение массы частицы на число частиц в единице объёма даст массу единицы объёма, т.е. плотность. Формально:
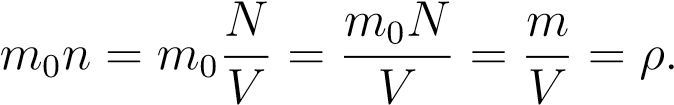
Итак, ρ = m0n.
Массы и размеры частиц невообразимо малы по нашим обычным меркам. Например, масса атома водорода порядка 10−24 г, размер атома порядка 10−8 см. Из-за столь малых значений масс и размеров число частиц в макроскопическом теле огромно.
Оперировать столь грандиозными числами, как число частиц, неудобно. Поэтому для измерения количества вещества используют специальную единицу — моль.
Один моль — это количество вещества, в котором содержится столько же атомов или молекул, сколько атомов содержится в 12 граммах углерода. А в 12 граммах углерода содержится примерно 6,02 · 1023 атомов. Стало быть, в одном моле вещества содержится 6,02 · 1023 частиц.
Это число называется постоянной Авогадро: NA = 6,02 · 1023 моль−1.
Количество вещества обозначается ν. Это число молей данного вещества.
Что получится, если ν умножить на NA? Число молей, умноженное на число частиц в моле, даст общее число частиц:
N = νNA.
Масса одного моля вещества называется молярной массой этого вещества и обозначается µ ([µ] = кг/моль). Ясно, что
m = µν.
Как найти молярную массу химического элемента? Оказывается, для этого достаточно заглянуть в таблицу Менделеева! Нужно просто взять атомную массу A (число нуклонов) данного элемента — это будет его молярная масса, выраженная в г/моль. Например, для алюминия A = 27, поэтому молярная масса алюминия равна 27 г/моль или 0,027 кг/моль.
Почему так получается? Очень просто. Молярная масса углерода равна 12 г/моль по определению. В то же время ядро атома углерода содержит 12 нуклонов. Выходит, что каждый нуклон вносит в молярную массу 1 г/моль. Поэтому молярная масса химического элемента с атомной массой A оказывается равной A г/моль.
Молярная масса вещества, молекула которого состоит из нескольких атомов, получается простым суммированием молярных масс. Так, молярная масса углекислого газа CO2 равна 12 + 16 · 2 = 44 г/моль = 0,044 кг/моль.
Будьте внимательны с молярными массами некоторых газов! Так, молярная масса газообразного водорода равна 2 г/моль, поскольку его молекула состоит из двух атомов (H2). То же касается часто встречающихся в задачах азота и кислорода (N2, O2). Вместе с тем, наиболее частый персонаж задач — гелий (He) — является одноатомным газом и имеет молярную массу 4 г/моль, предписанную таблицей Менделеева.
Ещё раз предостережение: при расчётах не забывайте переводить молярную массу в кг/моль! Если ваш ответ отличается от правильного на три порядка, то вы наверняка сделали именно эту, очень распространённую ошибку :-)
Что получится, если m0 умножить на NA? Масса частицы, умноженная на число частиц в моле, даст массу моля, т. е. молярную массу:
µ = m0NA.
Решение задач.
Задача №1
Какова масса 500 моль углекислого газа?
Дано: Решение:
υ = 500 моль υ =  => m=υ*M=500*44*10-3=22000*10-3=22 кг
=> m=υ*M=500*44*10-3=22000*10-3=22 кг
m-? Ответ:22 кг
Задача №2
Дата добавления: 2020-04-12; просмотров: 1588;











