Условие фазового равновесия.
Обычно определяется T, p и m.
Изменение массы m возможно только в случае нарушения фазового равновесия.
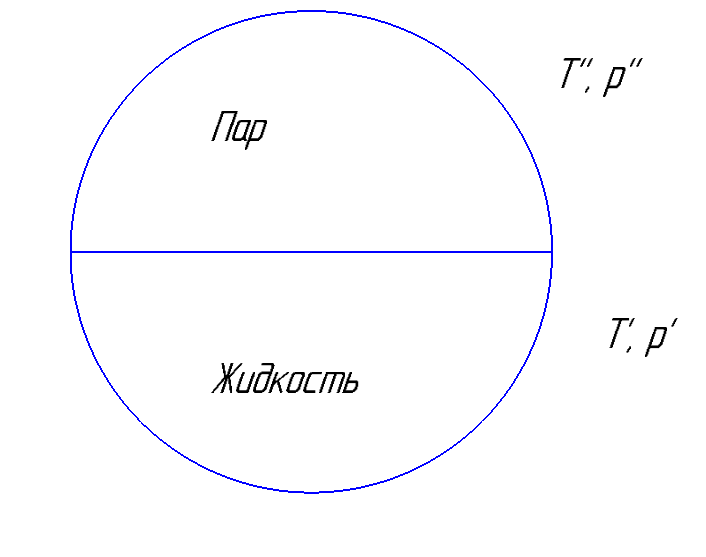
Рисунок 170. Иллюстрация равновесия пар-жидкость.
Изменение массы пара  массы жидкости
массы жидкости 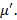
При фазовом равновесии необходимо выполнение следующих условий:
1) давление пара равно давлению жидкости:
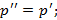
2) 
3) 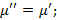
При нарушении любого из этих условий начнется переход к неравновесному состоянию. Поэтому при рассмотрении процессов разделения газовых смесей методом температурной ректификации необходимо знать условие фазового равновесия и причины, которые вывели систему из этого состояния. Удельный поток вещества определяется по следующей формуле при переходе из одной фазы в другую:
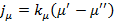 - коэффициент пропорциональности.
- коэффициент пропорциональности.
Перенос массы между фазами будет происходить в направлении туда, где 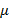 будет больше, из фазы, где
будет больше, из фазы, где 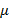 будет меньше, т.е. в нашем случае будет переход из пара в жидкость.
будет меньше, т.е. в нашем случае будет переход из пара в жидкость.
Изменение массы 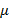 определяется как давлением и температурой, так и содержанием компонента смеси в данной фазе.
определяется как давлением и температурой, так и содержанием компонента смеси в данной фазе.
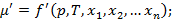
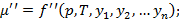
Изменение массы 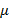 иногда называют химическим потенциалом. Последние два уравнения позволяют определить хим. потенциал при условии известности всех переменных, что обычно сделать очень трудно, поэтому вместо разности химических потенциалов рассматривают величины с ним связанные, а именно концентрации или мольные доли.
иногда называют химическим потенциалом. Последние два уравнения позволяют определить хим. потенциал при условии известности всех переменных, что обычно сделать очень трудно, поэтому вместо разности химических потенциалов рассматривают величины с ним связанные, а именно концентрации или мольные доли.
Лекция №27
Движущей силой процесса массопереноса в фазах (жидкой и газообразной) является разность равновесной концентрации и текущей концентрации.
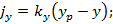

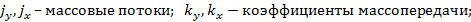
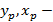 равновесные концентрации компонента в газообразной и жидкой фазе;
равновесные концентрации компонента в газообразной и жидкой фазе;
y, x – текущее (рабочее) значение концентраций.
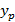 – равновесная концентрация компонента в газообразной фазе, если концентрация компонента в жидкой фазе равна x.
– равновесная концентрация компонента в газообразной фазе, если концентрация компонента в жидкой фазе равна x.

Рисунок 171. Иллюстрация равновесия пара над жидкостью.
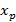 – равновесная концентрация компонента в газообразной фазе, если концентрация компонента в жидкой фазе равна y.
– равновесная концентрация компонента в газообразной фазе, если концентрация компонента в жидкой фазе равна y.
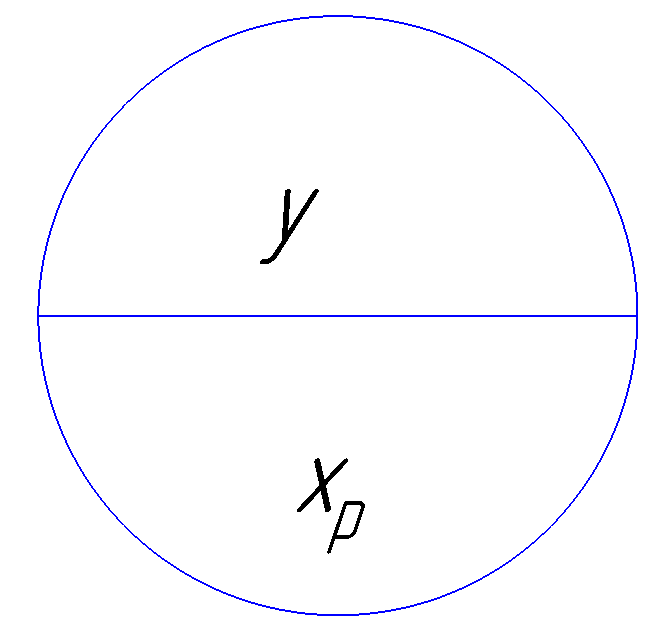
Рисунок 172. Иллюстрация равновесия жидкости под паром.
Чтобы рассчитать систему массопереноса в фазах, необходимо знать:
1) Свойства вещества для определения равновесных концентраций (прежде всего кривую упругости, т.е. зависимость 
Обычно концентрации или доли для насыщенного состояния прямо пропорционально давлению насыщенного пара.
2) Условие фазового равновесия, т.е. значение параметров, характеризующих смесь p, T, C при которых не происходит перенос массы из жидкой фазы в газ и наоборот при адиабатных условиях.
3) Действительные рабочие концентрации, которыми обладает смесь в отдельных частях массообменного аппарата.
-равновесные: 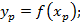
-рабочие: 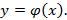
Физические свойства вещества – определяют равновесные концентрации. Обычно для реальных веществ получить аналитически уравнение 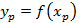 невозможно, поэтому реальные свойства вещества идеализируются, исходя из некоторых допущений.
невозможно, поэтому реальные свойства вещества идеализируются, исходя из некоторых допущений.
Рассматриваем бинарный раствор, обладающий идеальными свойствами в газовой и жидкостной фазе, поэтому можно использовать закон Дальтона и Рауля. Для условия равновесия прежде всего важно равенство T жидкой и газообразной фазы для бинарного раствора. Общее давление в газовой фазе равно сумме парциальных давлений первого и второго компонента в газовой фазе.
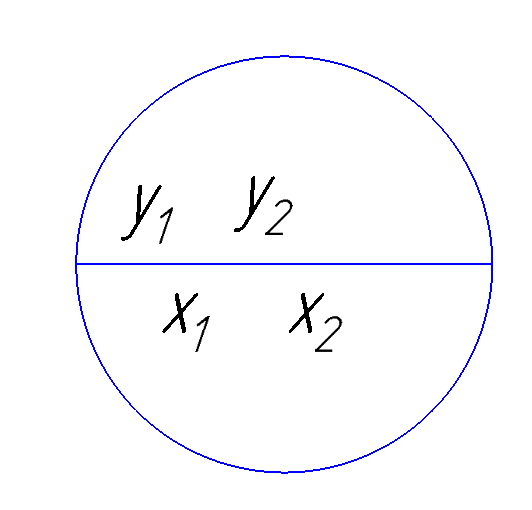
Рисунок 173. Иллюстрация равновесия бинарной смеси
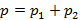 ;
;

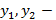 объемные концентрации компонентов в газовой фазе.
объемные концентрации компонентов в газовой фазе.
Т.к. 
Дата добавления: 2016-06-22; просмотров: 2494;











