Применение закона Рауля.
- устанавливает соответствие между давлением пара над жидкостной смесью в зависимости от концентрации данного компонента в жидкости:


Где 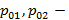 давления насыщенного пара первого и второго компонента смеси при данной температуре.
давления насыщенного пара первого и второго компонента смеси при данной температуре.
Исходя из законов Дальтона и Рауля можно записать зависимость давления газовой смеси от концентраций компонентов в жидкости:
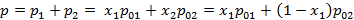
В результате получаем следующую систему:

Поэтому если знаем T и p газовой смеси, можно однозначно определить концентрации компонентов в жидкой и газообразной фазах, поскольку  и
и 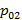 зависят только от температуры.
зависят только от температуры.
Бинарную смесь определяют 4 параметра: p, T, x, y.
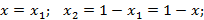

Поэтому по правилу Гиббса число независимых переменных для бинарной смеси, находящихся в жидком и газообразном состояниях, будет равно:
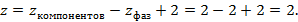
Поэтому нужно знать 2 любых неизвестных, чтобы определить остальные 2.
Общее давление газовой смеси обычно определяют как функцию концентрации компонента в жидкости для заданной константы температуры.

Рисунок 174. p-x диаграмма для бинарной смеси.
Если  ;
;
Если  .
.
Низкокипящий: 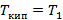
Высококипящий: 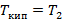
 .
.
Если 
Пример:
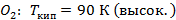
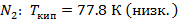
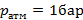

 - чистый низкокипящий компонент, а
- чистый низкокипящий компонент, а 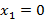 - чистый высококипящий компонент с давлением насыщенного пара меньше, чем у низкокипящего при одинаковой температуре.
- чистый высококипящий компонент с давлением насыщенного пара меньше, чем у низкокипящего при одинаковой температуре.
Найдем соотношение между концентрациями низкокипящего компонента в газовой и жидкой фазах:
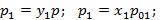
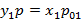 ;
;
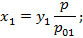
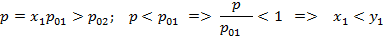

Рисунок 175. T-x,y диаграмма для бинарной смеси азот-кислород.
Для смеси  .
.
В жидкости концентрации низкокипящего компонента будет меньше, чем в газовой фазе, поскольку он более интенсивно испаряется по сравнению с высококипящим компонентом при p, T = const 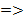 для воздуха, который можно представить в виде бинарной смеси
для воздуха, который можно представить в виде бинарной смеси 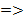 концентрация
концентрация 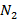 в паровой фазе будет выше, чем в жидкой и поэтому равновесная концентрация будет больше концентрации в жидкой фазе.
в паровой фазе будет выше, чем в жидкой и поэтому равновесная концентрация будет больше концентрации в жидкой фазе.
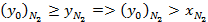
При дальнейшем рассмотрении бинарных смесей под x будем подразумевать концентрацию низкокипящего компонента в жидкой, а под y – концентрацию низкокипящего компонента в паровой фазе.
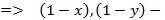 концентрации высококипящего компонента в жидкой и паровой фазах.
концентрации высококипящего компонента в жидкой и паровой фазах.
Если y = x для смеси, то такая смесь называется азеотропной, и методомнизкотемпературной ректификации ее разделить нельзя.
Процесс разделения с помощью ректификации основан на том, что концентрация низкокипящего компонента в паровой фазе будет выше, чем концентрация низкокипящего компонента в жидкости.
Найдем соотношение между равновесной концентрацией низкокипящего компонента в газовой фазе и концентрации этого компонента в жидкой фазе.

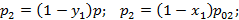

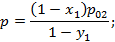
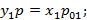
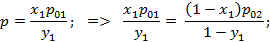

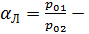 коэффициент летучести, равный отношению равновесного давления низкокипящего компонента к равновесному давлению высококипящего компонента при той же температуре.
коэффициент летучести, равный отношению равновесного давления низкокипящего компонента к равновесному давлению высококипящего компонента при той же температуре.
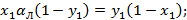
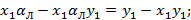

Если 
Зависимость имеет гиперболический вид, т.е. с увеличением x, y уменьшается.
Для реальных веществ это уравнение несправедливо, поскольку не учитывает специфику каждой индивидуальной смеси, поэтому для расчетов используются таблицы или диаграммы для реальных смесей (растворов). Обычно используются следующие 4 диаграммы, которые дают зависимости параметров смеси от концентрации низкокипящего компонента в жидкости:

Диаграмма 
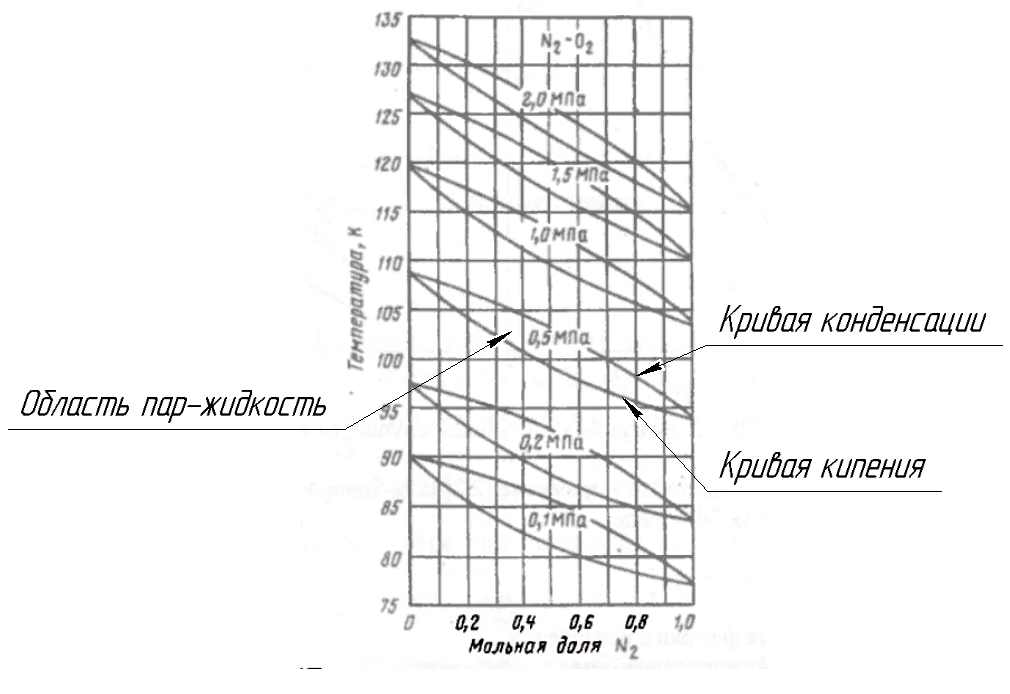
Рисунок 176. T-x,y диаграмма для бинарной смеси азот-кислород.
T1,T2 – температуры кипения (конденсации) низкокипящего и высококипящего компонента.
С ростом давления линии конденсирования и кипения поднимаются вверх:
С помощью диаграммы 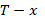 можно определить равновесные концентрации для данной p,T в паровой и жидкой фазах.
можно определить равновесные концентрации для данной p,T в паровой и жидкой фазах.
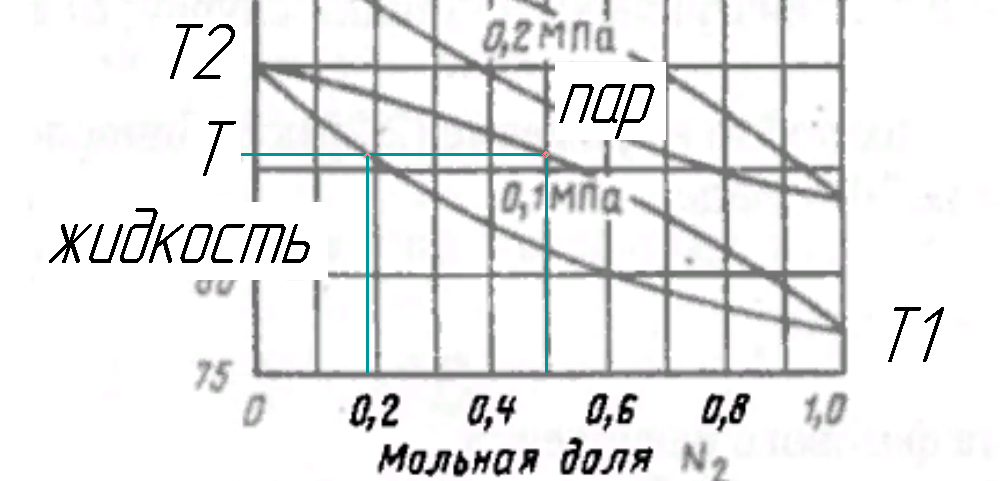
Рисунок 177.Определение состояния на T-x,y диаграмме по температуре.
Зависимость от p.
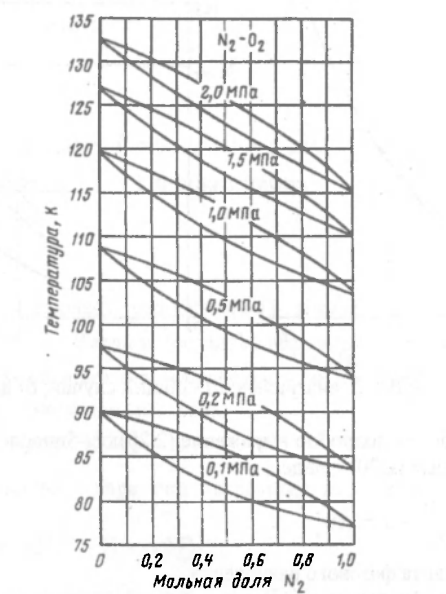
Рисунок 178. Зависимость кривых равновесия от давления.
С ростом давления линии кипения и конденсации смеси сближаются друг с другом, в результате с ростом давления разность между концентрациями низкокипящих компонент в паре и жидкости уменьшается => уменьшается движущая сила процесса газовой смеси и сметь при высоких давлениях разделить труднее, чем при низких.
Поэтому используют по возможности минимальное давление для разделения газовой смеси.
Диаграмма 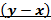
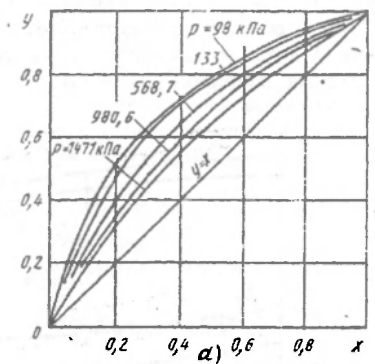
Рисунок 179. У-х диаграмма для низкокипящего компонента.
С ростом давления зависимость y(x) приближается к прямой y = x.
Точка (x=0,y=0) будет соответствовать чистому высококипящему компоненту;
(x=1,y=1) – чистому низкокипящему компоненту.
Поскольку движущая сила процесса  то:
то:
Графически (y - x) равен вертикальному отрезку между зависимостью и y = x, поэтому чем дальше зависимость от y = x, т.е. давление процесса меньше, тем более эффективно разделить данную смесь.
При больших давлениях для разделения требуется либо больше времени процесса, либо большая поверхность массообмена.
При расчете тройной смеси (N2 - О2 – Ar) можно использовать диаграммы бинарной смеси (N2- О2), и для получения более точных оценок необходимо использовать либо диаграмму тройной смеси или при использовании бинарной смеси занижать коэффициент эффективности процесса разделения.
Диаграмма 
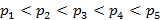
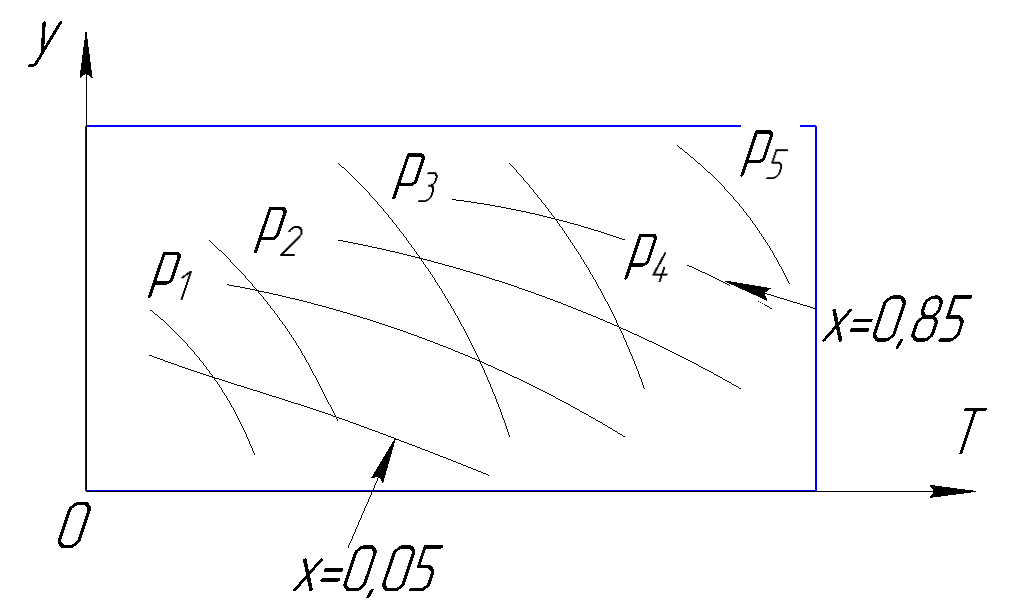
Рисунок 180. У-T диаграмма.
С помощью данной диаграммы можно, зная 2 параметра из 4, определить два остальных.
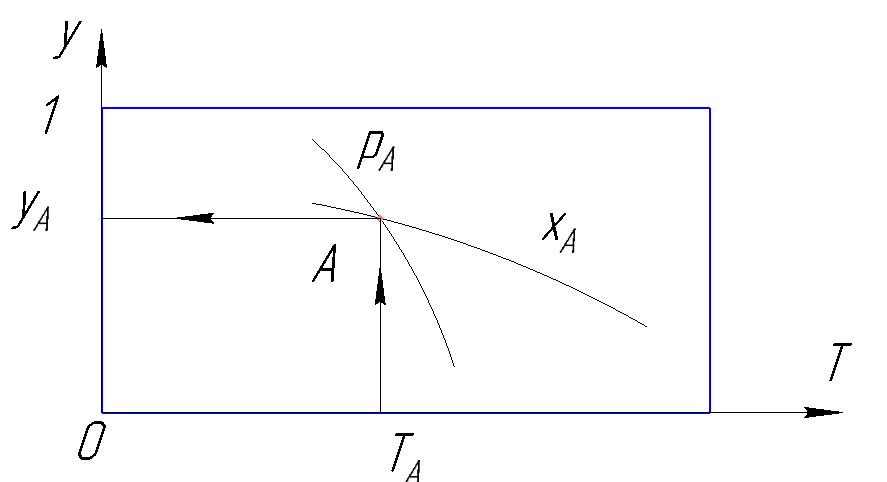
Рисунок 181.Определение состояния по у-T диаграмма.
Диаграмма 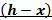
Рисунок 182. i-x диаграмма.
Зависимость от p: с ростом давления линии кипения и конденсации смещаются вверх.
С помощью этой диаграммы можно рассмотреть процесс дросселирования.
При дросселировании жидкой смеси, находящейся в состоянии насыщения получается парожидкостная смесь с уменьшением низкокипящего компонента в жидкой фазе и увеличением низкокипящего компонента в паровой фазе.
Чем больше величина концентрации низкокипящего компонента, тем труднее его разделить, в том числе и с помощью дросселирования, поскольку изотермы в h-x диаграмме идут более круто в двухфазной области при больших значениях x.
Изображение смешений смесевых поток на h-x диаграмме
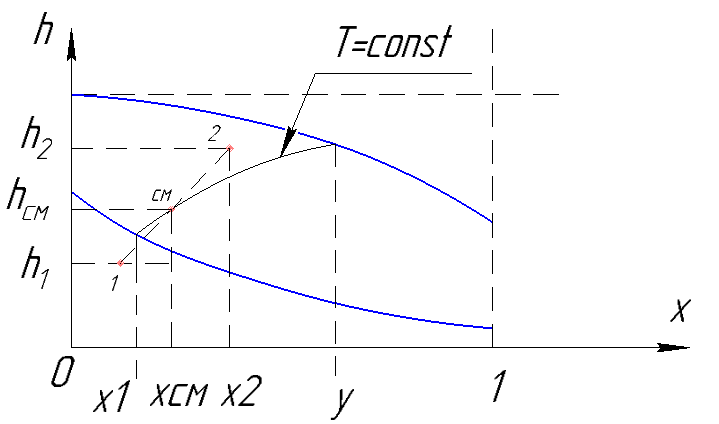
Рисунок 183. Смешение на i-x диаграмме.
Смешиваем два потока или два вещества, которые характеризуются точками 1 и 2.
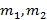 – количество первого и второго вещества, [моль];
– количество первого и второго вещества, [моль]; 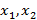 -
- 
Используем законы сохранения масс и энергии:

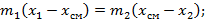

В результате точка смешения лежит на прямой, проходящей через точки, характеризующих параметры смешивающихся веществ на диаграмме, причем положение точки смешения определяется соотношениями между массами смешиваемых веществ.
Из закона сохранения энергии имеем:

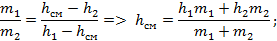
В результате смешения жидкости и влажного пара – также получаем влажный пар с большим количеством жидкости. Проведя через точку смешения изотерму, можно определить концентрации низкокипящего компонента в жидкой и паровой фазах.
Дата добавления: 2016-06-22; просмотров: 3591;











