Ионное произведение воды. Водородный показатель рН
Молекулы воды частично распадаются на ионы, то есть Н2О является слабым электролитом.
 или
или 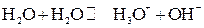
Этот процесс называется самоионизацией. Константа диссоциации воды:
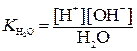 .
.
Опытом установлено, что в одном литре воды при комнатной температуре ( 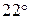 С) диссоциации подвергается лишь 10-7 моль воды и при этом образуется 10-7 моль/л ионов Н+ и 10-7 моль/л ионов ОН-.
С) диссоциации подвергается лишь 10-7 моль воды и при этом образуется 10-7 моль/л ионов Н+ и 10-7 моль/л ионов ОН-.
Произведение концентраций ионов водорода и гидроксид-ионов в воде называется ионным произведением воды (КВ). При определенной температуре КВ – величина постоянная, численно равная 10-14 (при 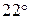 С)
С)
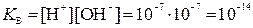 .
.
При расчетах, связанных с водными растворами электролитов, используют не концентрации, а активности ионов:
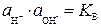
Активность Н+ и ОН- при 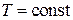 связаны между собой, если известна активность одного из них, можно определить активность другого.
связаны между собой, если известна активность одного из них, можно определить активность другого.
Ионы Н+ – носители кислотных свойств, а ионы ОН- – носители основных свойств.
Поэтому раствор будет нейтральным, если 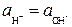 , кислым, если
, кислым, если 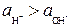 , щелочным при
, щелочным при 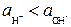 .
.
Для характеристики кислотности введен параметр – водородный показатель или рН.
Водородным показателем, или рН, называется взятый с обратным знаком десятичный логарифм активности ионов водорода в растворе:

Водородный показатель определяет характер реакции раствора.
Нейтральная среда при рН = 7 ( 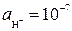 моль/л)
моль/л)
Кислая среда при рН < 7 ( 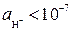 моль/л)
моль/л)
Щелочная при рН > 7 ( 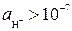 моль/л)
моль/л)
Значение рН = 7 соответствует нейтральному раствору только при 295 К ( 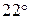 С).
С).
По аналогии рН введен показатель рОН
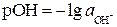
и показатель рКВ, равный
рКВ = -lgКВ,
следовательно
рКВ = рН + рОН.
Таким образом, зная рОН, можно рассчитать рН, и наоборот, по известному значению рН легко определяется рОН.
Водородный показатель имеет важное значение для понимания большинства процессов, протекающих в жидкой фазе, так как ионы Н+ и ОН- непосредственно участвуют во многих из этих процессов. Величина рН может служить критерием силы кислоты или основания. В ряду кислот более сильной будет та, у которой при одинаковой молярной концентрации активность ионов Н+ выше (рН ниже). Для оснований подобная зависимость имеет обратный характер.
Водородный показатель играет важную роль в жизнедеятельности организма, так в норме рН сыворотки крови 7,4 ± 0,05, слез – 7,4 ± 0,1, слюны – 6,65 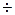 6,85, желудочного сока – 0,9
6,85, желудочного сока – 0,9 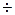 1,1… Отклонение рН от нормальных значений приводит к расстройству деятельности организма.
1,1… Отклонение рН от нормальных значений приводит к расстройству деятельности организма.
Расчет рН слабых и сильных кислот и оснований.При расчете рН слабых электролитов обычно принимают, что аН+ ≈ [Н+]. В этом случае
рН ≈ -lg[Н+].
Концентрации ионов водорода в растворе слабых кислот определяют по уравнению Оствальда:

аналогично для ионов ОН-
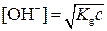
где Кg – константа диссоциации слабого электролита.
Гидролиз солей
Соли, как правило, являются сильными электролитами и диссоциируют в водных растворах полностью. Например, соль общей формулы KtAn (Kt – однозарядный катион, An – однозарядный анион) диссоциирует по уравнению:
KtAn → Kt+ + An-
Однако в водных растворах всегда присутствуют, хотя и в очень малой концентрации, ионы Н+ и ОН-.
Н2О ↔ Н+ + ОН-.
Если катион способен образовывать слабое основание KtOH, то в какой-то степени в растворе пойдет реакция его образования. В результате установится равновесие:
Kt+ + OH- ↔ KtOH
При этом концентрация ОН- ионов уменьшится и, следовательно, увеличится концентрация ионов Н+.
В растворе одновременно идут все процессы, соответствующие приведенным уравнениям. Суммарное уравнение этих процессов:
Kt+ + Н2О ↔ KtOH + Н+
Аналогично, если анион соли An- способен образовывать слабую кислоту HAn, то в растворе идет реакция ее образования:
An- + Н2О ↔ HAn + ОН-.
Реакция катиона или аниона соли с водой называется гидролизом. В результате гидролиза смещается ионное рвновесие воды, и в растворе этих солей появляется избыток ионов Н+ или ОН-. Равновесие реакции гидролиза обычно смещено в сторону образования очень слабого электролита – воды, т. е. в сторону обратного процесса. Соли, образованные сильными кислотами и основаниями гидролизу не подвергаются, например NaCl.
Типы гидролиза
1. Гидролиз соли, образованной слабой кислотой и сильным основанием, например KNO2. Соль в растворе полностью диссоциирует на ионы:
KNO2 → K+ + NO2-
Вода, как уже отмечалось, является слабым электролитом:
Н2О ↔ Н+ + ОН-
Ионы водорода воды взаимодействуют с нитрит-ионами с образованием слабой азотистой кислоты:
KNO2 + Н2О ↔ КОН + НNO2
Или в ионной форме
NO2- + Н2О ↔ НNO2 + ОН-
Гидролизу подвергается анион соли, в молекулы слабого электролита связываются ионы Н+, а в растворе накапливаются свободные ионы ОН-. Реакция раствора щелочная, рН > 7.
Если соль образована многоосновной кислотой, гидролиз идет ступенчато:
Na2CO3 → 2Na+ + CO32-
Н2О ↔ Н+ + ОН-
I ступень Na2CO3 + Н2О ↔ NaHCO3 + NaOH
CO32- + Н2О ↔ HCO3- + ОН-
II ступень NaHCO3 + Н2О ↔ H2CO3 + NaOH
HCO3- + Н2О ↔ H2CO3 + ОН-
2. Гидролиз соли, образованной сильной кислотой и слабым основанием, например NH4Cl.
NH4Cl → NH4+ + Cl-
Н2О ↔ Н+ + ОН-
NH4Cl + Н2О ↔ NH4OH + HCl
NH4+ + Н2О ↔ NH4OH + Н+
В этом случае гидролизу подвергается катион соли, который связывает ионы ОН- в молекулы слабого электролита NH4OH. При этом в растворе накапливаются ионы Н+, среда раствора кислая, рН < 7. Если основание, образующее соль, многокислотное, гидролиз идет ступенчато:
SnCl2 → Sn2+ + 2Cl-
Н2О ↔ Н+ + ОН-
I ступень SnCl2 + Н2О ↔ SnOHCl + HCl
Sn2+ + Н2О ↔ SnOH+ + Н+
II ступень SnOHCl + Н2О ↔ Sn(OH)2 + HCl
SnOH+ + Н2О ↔ Sn(OH)2 + Н+
Практически гидролиз подобных солей протекает по I ступени и сопровождается образованием основных солей.
3. Гидролиз соли, образованной слабой кислотой и слабым основанием. В растворах этих солей гидролизуются и катион, и анион. Реакция раствора может быть нейтральной, слабокислой или слабощелочной в зависимости от силы кислоты и основания, образующих соль. Так, реакция раствора CH3COONH4 нейтральная, так как константы диссоциации NH4OH и CH3COOH практически равны.
CH3COONH4 + Н2О ↔ CH3COOH + NH4OH
CH3COO- + NH4+ + Н2О ↔ CH3COOH + NH4OH
Соли, образованные слабыми трехкислотными основаниями и слабыми летучими многоосновными кислотами, подвергаются полному гидролизу:
Fe2(CO3)2 + 3H2O = Fe(OH)3↓ + 3CO2↑
Гидролиз этих солей необратим, они не существуют в водных растворах и не могут быть получены реакциями обмена в водных растворах.
Константа гидролиза. Равновесие константы гидролиза катиона описывается согласно закону действующих масс уравнением:

 является постоянной величиной, следовательно, уравнение для константы гидролиза принимает вид:
является постоянной величиной, следовательно, уравнение для константы гидролиза принимает вид:
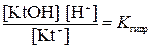 (5.1.)
(5.1.)
Равновесие гидролиза является по сути дела суммарным результатом двух равновесий – равновесия диссоциации воды и диссоциации (ассоциации) слабого основания KtOH. Поэтому 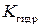 легко выразить через константы этих двух равновесий KВ и KKtOH. Действительно, умножив числитель и знаменатель левой части этого уравнения на [OH-], получим:
легко выразить через константы этих двух равновесий KВ и KKtOH. Действительно, умножив числитель и знаменатель левой части этого уравнения на [OH-], получим:
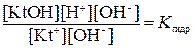
В левой части этого уравнения
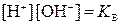 , а
, а 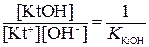
Отсюда следует:
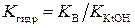 (5.2.)
(5.2.)
При гидролизе аниона имеет место равновесие, для которого справедливо уравнение:
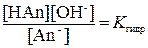
Здесь KHAn – константа диссоциации слабой кислоты.
Если у соли гидролизуется и катион, и анион, например:
Kt+ + An- + H2O ↔KtOH + НАn,
то равновесие гидролиза можно описать уравнением:
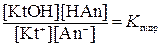 .
.
Умножая и числитель, и знаменатель левой части уравнения на [H+] и [OH-], получим:
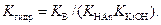
Степень гидролиза. Процесс гидролиза часто характеризуют степенью гидролиза. Под степенью гидролиза h понимают отношение числа гидролизованных молекул к общему числу растворенных молекул:
 .
.
Степень гидролиза выражается в процентах или долях и изменяется в пределах: 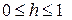 или
или 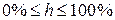 .
.
Число гидролизованных молекул и число растворенных молекул пропорциональны их концентрациям в растворе. Поэтому степень гидролиза можно выражать следующим образом. В случае гидролиза катиона:
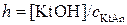 .
.
Здесь [KtOH] – концентрация слабого основания, равная концентрации гидролизованной соли [KtAn].
В случае гидролиза аниона:
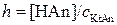
Здесь [HAn] – концентрация слабой кислоты, равная концентрации гидролизованной соли [KtAn].
Степень гидролиза легко рассчитать, если известна концентрация гидролизующейся соли СKtAn и 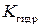 . Найдем степень гидролиза соли KtAn, у которой гидролизуется катион, т. е. идет процесс:
. Найдем степень гидролиза соли KtAn, у которой гидролизуется катион, т. е. идет процесс:
Kt+ + Н2О ↔ KtOH + Н+
Это равновесие описывается уравнением
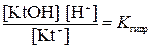 ,
,
следовательно

Из уравнения гидролиза имеем:
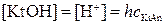
Общая концентрация соли KtAn складывается из концентрации негидролизованных ионов [Kt+] и гидролизованных молекул [KtOH]:
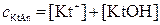
Подставив значения [Kt+] и [KtOH] в выражения (5.1) и (5.2), получим:
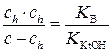 ;
;  .
.
Если h << 1, то 1 – h → 1. Тогда
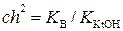 ;
;
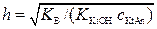 . (5.3.)
. (5.3.)
Из уравнения (5.3.) следует:
1.Степень гидролиза увеличивается при повышении температуры, так как при этом возрастает KВ.
2. Степень гидролиза тем больше, чем слабее основание, образующее соль.
3. Степень гидролиза увеличивается при разбавлении раствора соли.
Для солей, образованных одноосновными слабыми кислотами и однокислотными сильными основаниями, степень гидролиза рассчитывают аналогично:
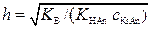 .
.
Для солей, у которых гидролизуется и катион, и анион:
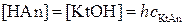 ,
,
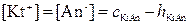 .
.
Тогда, если h << 1:
 (5.4)
(5.4)
Из уравнения (5.4.) следует:
1. Степень гидролиза солей этого типа значительно больше, чем у рассмотренных выше.
2. Степень гидролиза солей, образованных слабыми одноосновными кислотами и слабыми однокислотными основаниями, не зависит от концентрации.
Взаимодействие растворов двух солей, взаимно усиливающих гидролиз друг друга. В растворах  и
и 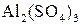 , взятых порознь, устанавливаются равновесия:
, взятых порознь, устанавливаются равновесия:
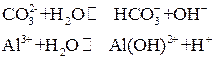
и гидролиз обеих солей ограничивается практически этой первой стадией. Если смешать растворы этих солей, то ионы Н+ и ОН– взаимно нейтрализуют друг друга, а уход этих ионов из сферы реакции в виде малодиссоциированной воды смещает оба равновесия вправо и активизирует последующие ступени гидролиза:

что в конечном счете приводит к образованию основания и кислоты:

или в молекулярно-ионной форме
2 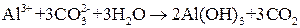 .
.
По этой схеме взаимного усиления гидролиза, приводящего к образованию основания и кислоты, взаимодействуют соли трехвалентного железа и хрома с карбонатами щелочных металлов, соли алюминия и хрома с сульфидом аммония, алюминаты с солями аммония, растворы которых имеют кислую реакцию, и некоторые другие.
Дата добавления: 2020-03-21; просмотров: 568;











