Дисперсные системы и их классификация
В середине 19 века английский химик Томас Грэм (1805-1869) обнаружил вещества с загадочными свойствами. При выпаривании их растворов вместо кристаллов получались аморфные студенистые массы. Они имели клеющие свойства. По-гречески клей – «колла», поэтому Грэм назвал эти вещества коллоидами.
Позже выяснилось, что из одного и того же вещества можно приготовить и обычный, и коллоидный раствор. Просто в обычных растворах вещество находится в виде отдельных молекул или ионов, а в коллоидных в виде крупных частиц.
Например, поваренная соль в органическом растворителе (бензоле) образует типичную коллоидную систему.
В любом коллоиде выделяются две фазы: сплошная (дисперсионная среда) и дисперсная или прерывистая – мелкие твердые частицы, капли жидкости или пузырьки газа.
Крайне редки газы, жидкости или твердые материалы, в которых отсутствуют коллоидные частицы.
Гелеобразную структуру имеет даже головной мозг. И. И. Жуков (представитель коллоидной химии) говорил, что «человек – ходячий коллоид».
В зависимости от размера частиц дисперсные системы подразделяют на группы:
а) взвеси (суспензии, эмульсии), у которых частицы имеют размер 10-6 м и более (1000 нм);
б) коллоидные системы, размер частиц (от 10-9 м до 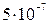 м) от 1 до 500 нм.
м) от 1 до 500 нм.
Дисперсные системы также классифицируют по агрегатному состоянию дисперсной фазы и дисперсионной среды.
| Тип дисперсной системы | Фазовое состояние | Примеры | |
| дисперсионной среды | дисперсной фазы | ||
| аэрозоль | газ | жидкость | туман, облака |
| аэрозоль | газ | твердая | дым, пыль |
| пена | жидкая | газ | взбитые сливки, мыльная пена |
| эмульсия emulgere (лат.) | жидкая «доить» (т. к. первая изученная эмульсия – молоко) | жидкая | молоко, кровь, майонез |
| золь | жидкая | твердая | краски |
| твердая эмульсия | твердая | жидкая | масло |
| гель | твердая | жидкая | желе, агар-агар |
| твердая | газ | пемза, пенопласт |
Коллоидные растворы.Коллоидное состояние характерно для многих веществ, если их частицы имеют размер от 1 до 500 нм (10-9 м  м).
м).
Коллоидная частица имеет сложное строение.
Она включает в себя:
1) ядро;
2) адсорбированные ионы;
3) противоионы;
4) растворитель.
Примеры коллоидных частиц:

ядро
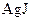
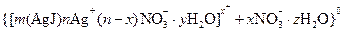
золь

ядро
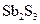
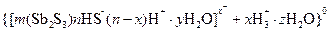
золь

ядро
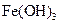
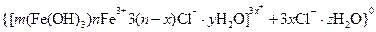
золь
Как видно, ядро состоит из электронейтрального агрегата с адсорбированными ионами элементов ( 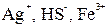 ).
).
Коллоидная частица кроме ядра имеет противоионы и молекулы растворителя.
Адсорбированные ионы и противоионы с растворителями образуют адсорбированный слой.
Заряд коллоидной частицы равен разности зарядов адсорбированных ионов и противоионов.
Вокруг частиц находится диффузный слой ионов, заряд которых равен заряду коллоидной частицы. Коллоидная частица и диффузный слой образуют электронейтральную мицеллу.
Методы получения коллоидных растворов.Для приготовления коллоидных растворов следует получить частицы размером от 1 до 500 нм, подобрать дисперсионную среду, в которой не растворяется вещество частиц, обеспечить устойчивость частиц.
Частицы соответствующих размеров получают:
I. Дробление крупных частиц. Эти методы называются диспергационными.
1) механическое диспергирование (раздавливание, расщепление, истирание);
2) ультразвуковое диспергирование;
3) электрическое диспергирование.
II. Объединение молекул или ионов. Такие методы называются конденсационными.
1) конденсация из паров при понижении температуры;
2) метод замены растворителя – дисперсионная фаза возникает вследствие меньшей растворимости вещества в новом растворителе.
3) химические методы (дисперсионная фаза возникает в результате ОВР, гидролиза или реакции обмена. Например, в результате гидролиза солей железа (III) получают его гидроксид: 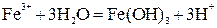 ).
).
В качестве вещества коллоидных частиц в водных средах служат металлы, оксиды, гидрокисды, сульфиды и другие. Для повышения устойчивости коллоидов в раствор вводят стабилизаторы, например, ПАВ или ионы вещества, из которого состоит частица.
Дата добавления: 2020-03-21; просмотров: 536;











