Теории кислот и оснований
Кислотно-основные взаимодействия широко распространены в природе и технике, поэтому давно привлекали внимание ученых, предложивших несколько теорий этих процессов. Большинство теорий не противоречат друг другу, но имеют различные области применения. Наиболее известны теория, основанная на механизме электролитической диссоциации, протонная и электронная теории кислот и оснований.
Согласно теории электролитической диссоциации, применимой к водным растворам, кислотой является электролит, который диссоциирует с образованием ионов Н+. Сильные кислоты диссоциируют практически полностью, у слабых диссоциирована лишь часть молекул. О силе кислот можно судить по константе диссоциации. Чем больше константа диссоциации, тем более диссоциирована кислота.
Электролит, диссоциирующий с образованием ионов ОН-, называют основанием.
Существуют электролиты, которые могут диссоциировать как кислоты, и как основания:
H+ + RO- ↔ ROH ↔ R+ + OH-
Такие электролиты называют амфотерными электролитами. Амфотерность электролитов объясняется малым различием связей R –H и
O – H. Примером амфотерного электролита может быть гидроксид цинка:
2H+ + [Zn(OH)4]2- ↔ Zn(OH)2 + 2H2O ↔ [Zn(H2O)2]2+ + 2OH-
При взаимодействии гидроксида цинка, например, с азотной кислотой образуется нитрат цинка:
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
при взаимодействии же с гидроксидом калия – цинкат калия:
Zn(OH)2 + 2KOH = K2[Zn(OH)4]
К амфотерным электролитам также относятся гидроксиды алюминия Al(OH)3, свинца Pb(OH)2, олова Sn(OH)2 и др.
Теория электролитической диссоциации неприменима к взаимодействиям, не сопровождающимся диссоциацией на ионы. Например, аммиак, реагируя с безводным фторидом водорода, образует соль фторид аммония NH3 + HF = NH4F. Аммиак, не имея в своем составе гидроксидной группы, ведет себя как основание.
В 1923 г. Д. Брендстедом была предложена протонная теория кислот и оснований, применяемая как к водным, так и неводным средам. Согласно протонной теории, кислоту считают донором протонов, а основание – акцептором протонов. При взаимодействии кислота отдает, а основание принимает протон. Соотношение между основанием и кислотой можно представить схемой
Основание + Протон → Кислота
Основание и кислота, связанные данным соотношением, называются сопряженными. Взаимодействие между кислотой и основанием согласно протонной теории обозначается схемой
Кислота 1 + Основание 2 = Кислота 2 + Основание 1
Например, реакцию аммиака и фторида водорода можно записать уравнением
HF + NH3 ↔ NH4+ + F-
Кислота 1 Основание 2 Кислота 2 Основание 1
В этом уравнении кислоте HF соответствует сопряженное основание F-, а основанию NH3 – сопряженная кислота NH4+. В зависимости от партнера то или иное вещество может быть или кислотой, или основанием. Например, вода по отношению к аммиаку является кислотой, а по отношению к фториду водорода – основанием:
H2O + NH3 ↔ OH- + NH4+
HF + H2O ↔ F- + Н3О+
кислота основание основание кислота
Таким образом, как и во всех протолитических процессах, продуктом взаимодействия кислоты и основания является не соль, а сопряженные кислота и основание.
В 1924 г. Дж. Льюис выдвинул и обосновал электронную теорию кислот и оснований, согласно которой кислота является акцептором, а основание – донором электронов. Если в состав кислоты входит водород, то она называется водородной. Однако кислота может и не содержать атома водорода, такая кислота называется апротонной. Взаимодействие кислоты и основания, по Льюису, приводит к образованию ковалентной связи по донорно-акцепторному механизму:
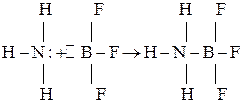
основание кислота продукт нейтрализации
Электронная теория охватывает более широкий круг соединений, чем протонная теория.
Дата добавления: 2020-03-21; просмотров: 533;











