Ионные реакции в растворах
При нейтрализации любой сильной кислоты любым сильным основанием на каждый моль образующейся воды выделяется около 57,6 кДж теплоты:
HCl + NaOH = NaCl + H2O + 57,53 кДж;
HNO3 + KOH = KNO3 + H2O + 57,61 кДж.
Это говорит о том, что подобные реакции сводятся к одному процессу. Уравнение этого процесса мы получим, если рассмотрим подробнее одну из приведенных реакций, например, первую. Перепишем ее уравнение, записывая сильные электролиты в ионной форме, поскольку они существуют в растворе в виде ионов, а слабые – в молекулярной, поскольку они находятся в растворе преимущественно в виде молекул:
H+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O.
Рассматривая получившееся уравнение, видим, что в ходе реакции ионы Na+ и Cl- не претерпели изменений. Поэтому перепишем уравнение еще раз, исключив эти ионы из обеих частей уравнения:
H+ + OH- = H2O.
Таким образом, реакции нейтрализации любой сильной кислоты любым сильным основанием сводятся к образованию молекул воды из ионов водорода и гидроксид-ионов. Ясно, что тепловые эффекты этих реакций тоже должны быть одинаковы.
Строго говоря, реакция образования воды из ионов обратима, что можно выразить уравнением:
H+ + OH- ↔ H2O.
Протекание реакции между электролитами возможно в 3-х случаях:
1. Если ионы, соединяясь, образуют труднорастворимое соединение:
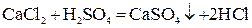 ;
;
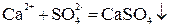 .
.
2. Если образуется летучее вещество:
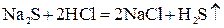 ;
;
 .
.
3. Если образуется малодиссоциирующий электролит:
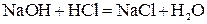 ;
;
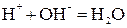 .
.
На основании ионного уравнения делают вывод о том, присутствие каких ионов необходимо для получения данного продукта реакции. Ионная форма уравнения реакции показывает и направление протекания этой реакции: реакция протекает в направлении связывания одного или более ионов в более прочное соединение, т. е. уменьшения концентрации его в растворе.
Дата добавления: 2020-03-21; просмотров: 533;











