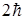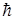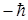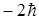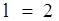Линейчатый спектр атома водорода
Спектр излучения атомарного водорода состоит из отдельных спектральных линий, которые располагаются в определенном порядке. В 1885 г. Бальмер установил, что длины волн (или частоты) этих линий могут быть представлены формулой. Действительно, из (7) с учетом (6) для водорода (Z = 1), следует, что

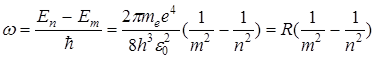 , (8)
, (8)
где R = 2,07× 1016 с -1 – постоянная Ридберга. Учитывая, что 1/l = v/с = w/2pс и используя (8), найдем
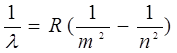 , (9)
, (9)
где R =1,0974×107 м-1 – называется также постоянной Ридберга.
На рис. 1 изображена схема энергетических уровней атома водорода, рассчитанных согласно (6) при z = 1.
Еn, эВ
 0 n = ¥
0 n = ¥
|
n = 4
|
|
СП
|
|
СБ

|  |
СЛ
При переходе электрона с более высоких энергетических уровней на уровень n=1 возникает ультрафиолетовое излучение или излучение серии Лаймана (СЛ). Когда электроны переходя на уровень n = 2 возникает видимое излучение или излучение серии Бальмера (СБ). При переходе электронов с более высоких уровней на уровень n = 3 возникает инфракрасное излучение, или излучение серии Пашена (СП) и т.д.
Частоты или длины волн, возникающего при этом излучения, определяются по формулам (8) или (9) при m=1 – для серии Лаймана, при m=2 – для серии Бальмера и при m = 3 – для серии Пашена. Энергия фотонов определяется по формуле (7), которую с учетом (6) можно привести для водородоподобных атомов к виду:
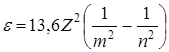 , эВ (10)
, эВ (10)
Теория Бора сыграла огромную роль в создании атомной физики. В период ее развития (1913 – 1925 г.) были сделаны важные открытия, например, в области атомной спектроскопии. Однако в теории Бора обнаружились существенные недостатки, например, с ее помощью невозможно создать теорию более сложных, чем атом водорода, атомов. Поэтому становилось очевидным, что теория Бора представляет собой переходной этап на пути создания последовательной теории атомных и ядерных явлений. Такой последовательной теорией явилась квантовая (волновая) механика.
11.4 Атом водорода согласно квантовой механики. Квантовые числа электрона в атоме
Результаты, полученные согласно теории Бора в решении задачи об энергетических уровнях электрона в водородоподобных атомах, получены в квантовой механике без привлечения постулатов Бора. Покажем это.
Состояние электрона в водородоподобном атоме описывается некоторой волновой функцией y, удовлетворяющей стационарному уравнению Шредингера [см.(9.22)]. Учитывая, что потенциальная энергия электрона
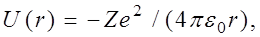 (11)
(11)
где r – расстояние между электроном и ядром, получим уравнение Шредингера в виде
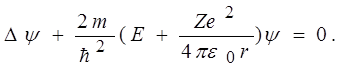 (12)
(12)
Целесообразно воспользоваться сферической системой координат r, q, j и искать решение этого уравнения в виде следующих собственных функций

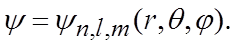 (13)
(13)
где n, l, m – целочисленные параметры собственных функций. При этом n – называют главным квантовым числом, l – орбитальным (азимутальным) и m – магнитным квантовым числом.
Доказывается, что уравнение (12) имеет решение только при дискретных отрицательных значениях энергии
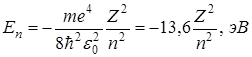 , (14)
, (14)
где n = 1, 2, 3,... – главные квантовые числа.
Сравнение с выражением (6) показывает, что квантовая механика приводит к таким же значениям энергии, какие получились и в теории Бора. Однако в квантовой механике эти значения получаются как следствие основных положений этой науки.
Подставив в (14 ) Z = 1 и приняв n = 1, получим значение энергии основного состояния (т.е. состояния с наименьшей энергией) атома водорода
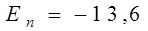 эВ. (15)
эВ. (15)
Из решения (13) уравнения Шредингера (12) также следует, что момент импульса электрона в атоме квантуется по формуле
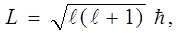 (16)
(16)
где l= 0, 1, 2, ... (n-1) – орбитальное (азимутальное) квантовое число.
Проекция момента импульса L электрона на направление Z магнитного поля может принимать лишь целочисленные значения, кратные  (пространственное квантование) т.е.
(пространственное квантование) т.е.
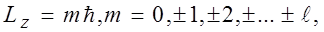 (17)
(17)
m – называют магнитным квантовым числом. При данном 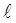 магнитное квантовое число может принимать
магнитное квантовое число может принимать 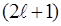 различных значений.
различных значений.
|
|

 |  |

l=1 l=2
Рис. 2
Первоначально предполагалось, что спин обусловлен вращением электрона вокруг своей оси. Позднее было показано, что спин имеет квантовую природу. Спин следует считать внутренним свойством, присущим электрону, подобно тому, как ему присущ и заряд и масса.
Собственный момент импульса электрона LS (спин) выражается через спиновое квантовое число s равное 1/2, т.е. спин квантуется по закону
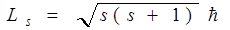 .
.
Проекция спина на заданное направление z может принимать два квантованных значения
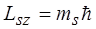 ,
,
где ms = ± s = ± 1/2 называют магнитным спиновым квантовым числом или просто спиновым квантовым числом, т.е. также как и s.
Принцип Паули
Итак, состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами:
1. Главное квантовое число n (n = 1, 2 ... ¥).
2. Орбитальное (азимутальное) квантовое число l (l = 0, 1, 2, ... n-1)
3. Магнитное квантовое число m (m = 0, ± 1, ± 2, ± ... ± l)
4. Спиновое квантовое число ms (ms = ± 1/2 ).
Для одного фиксированного значения главного квантового числа n существует 2n2 различных квантовых состояний электрона.
Один из законов квантовой механики, называемый принципом Паули, утверждает:
В одном и том же атоме не может быть двух электронов, обладающих одинаковым набором квантовых чисел, (т.е. не может быть двух электронов в одинаковом состоянии).
Принцип Паули дает объяснение периодической повторяемости свойств атома, т.е. периодической системе элементов Менделеева.
Дата добавления: 2016-06-22; просмотров: 1530;