Метод гипервалентных связей
Метод МО, основанный на рассмотрении химических соединений как единой системы с делокализованными молекулярными орбиталями, позволяет получить наиболее полное описание электронного строения разнообразных химических соединений. Причем, чем в большей степени делокализованы в пространстве исходные АО компонентов системы, тем большей степенью делокализации характеризуются и образующиеся из них МО. В связи с этим, наиболее существенные различия между двумя квантовохимическими методами описания электронного строения химических соединений - на основе делокализованных многоцентровых молекулярных орбиталей (метод МО) и локализованных двухцентровых двухэлектронных связей (метод ВС) наблюдается для соединений переходных элементов, характеризующихся участием в химических связях трехмерно делокализованных d- и f-орбиталей. В тоже время, валентные s- и р-орбитали, участвующие в образовании химических связей в соединениях непереходных элементов, в значительной степени локализованы в пространстве между соседними атомами и, как следствие этого, молекулярные орбитали на их основе носят преимущественно двух- и трехцентровый характер. Это позволяет рассматривать электронное строение соединений непереходных элементов на основе совокупности двух- и трехцентровых взаимодействий валентных np- и ns-орбиталей центрального атома с лигандами без участия свободных nd-орбиталей. Такой подход описания электронного строения соединений непереходных элементов получил название метода гипервалентных связей (ГВС).
В методе ГВС различают следующие взаимодействия, приводящие к образованию соединений непереходных элементов:
- ковалентные двухцентровые двухэлектронные химические связи (CV), возникающие при взаимодействии занятой одним электроном валентной р-орбитали центрального атома (А) с занятой неспаренным электроном валентной р-орбиталью лиганда (Х), при этом образуется заполненная электронами s-связывающая и свободная s*-разрыхляющая МО. Такие химические связи А-Х характеризуются единичной кратностью, относительно высокой энергией связи и являются устойчивыми. Соединениями с ковалентными двухцентровыми двухэлектронными связями являются – например, ClF, SF2, PF3 с одной, двумя и тремя ковалентными связями центрального атома с фторидными лигандами;
- 
 гипервалентные (HV) трехцентровые четырехэлектронные связи (их называют также орбитально-дефицитными), в каждой из которых занятая парой электронов р- или s-орбиталь центрального атома (А) взаимодействует с двумя валентными орбиталями лигандов (Х), занятых по одному электрону. При этом образуются трехцентровые s-связывающая и s*-разрыхляющая МО, а также несвязывающая МО, локализованная на лигандах. В зависимости от того р- или s-орбиталь центрального атома участвует в образовании гипервалентной связи, различают соответственно гипервалентные–1 (HV-1 – ClF3, ClF5, SF4) и гипервалентные-2 (HV-2 – ClF7, SF6, PF5) связи. Трехцентровые МО связей HV-1 линейных фрагментов Х-А-Х направлены вдоль соответствующих осей координат под прямым углом. В случае HV-2 связей участие ns орбиталей центрального атома А в высшей степени окисления обеспечивает наиболее симметричную геометрию молекулы. За счет большего экранирования внутренними электронными слоями валентных s-электронов центрального атома по сравнению с р-электронами, связи HV-1 являются относительно более прочными, чем HV-2.
гипервалентные (HV) трехцентровые четырехэлектронные связи (их называют также орбитально-дефицитными), в каждой из которых занятая парой электронов р- или s-орбиталь центрального атома (А) взаимодействует с двумя валентными орбиталями лигандов (Х), занятых по одному электрону. При этом образуются трехцентровые s-связывающая и s*-разрыхляющая МО, а также несвязывающая МО, локализованная на лигандах. В зависимости от того р- или s-орбиталь центрального атома участвует в образовании гипервалентной связи, различают соответственно гипервалентные–1 (HV-1 – ClF3, ClF5, SF4) и гипервалентные-2 (HV-2 – ClF7, SF6, PF5) связи. Трехцентровые МО связей HV-1 линейных фрагментов Х-А-Х направлены вдоль соответствующих осей координат под прямым углом. В случае HV-2 связей участие ns орбиталей центрального атома А в высшей степени окисления обеспечивает наиболее симметричную геометрию молекулы. За счет большего экранирования внутренними электронными слоями валентных s-электронов центрального атома по сравнению с р-электронами, связи HV-1 являются относительно более прочными, чем HV-2.
- 
 орбитально-избыточные (OS) трехцентровые двухэлектронные связи, в каждой из которых занятая неспаренным электроном валентная орбиталь центрального атома А взаимодействует с двумя валентными орбиталями лигандов, содержащими один электрон. При этом также образуется три МО, нижняя связывающая из которых занята парой электронов. Образование OS-связей характерно для электронно-дефицитных молекул – например, диборана B2H6, общее число валентных электронов которых 12 не хватает для образования 8 двухэлектронных двухцентровых связей. Две концевые группы BH2 лежат в одной плоскости, а атомы B и H образуют двухцентровые CV связи. Два же центральных атома водорода расположены симметрично выше и ниже этой плоскости и объединены трехцентровыми B-H-B орбитально-избыточными связями.
орбитально-избыточные (OS) трехцентровые двухэлектронные связи, в каждой из которых занятая неспаренным электроном валентная орбиталь центрального атома А взаимодействует с двумя валентными орбиталями лигандов, содержащими один электрон. При этом также образуется три МО, нижняя связывающая из которых занята парой электронов. Образование OS-связей характерно для электронно-дефицитных молекул – например, диборана B2H6, общее число валентных электронов которых 12 не хватает для образования 8 двухэлектронных двухцентровых связей. Две концевые группы BH2 лежат в одной плоскости, а атомы B и H образуют двухцентровые CV связи. Два же центральных атома водорода расположены симметрично выше и ниже этой плоскости и объединены трехцентровыми B-H-B орбитально-избыточными связями.
Гипервалентные орбитально-дефицитные и орбитально-избыточные связи по сравнению с ковалентными характеризуются меньшей кратностью [К = (2-0)/(2×2) = 1/2) и энергией индивидуальной А-Х связи. Анализ перераспределения электронной плотности между центральным атомом и лигандами при образовании гипервалентных связей -dХ 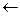 А+2d
А+2d 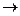 Хd- показывает, что выигрыш в энергии системы по сравнению с исходными атомами, зависит от энергетического положения s-связывающей МО по отношению к энергии валентной орбитали центрального атома. Поскольку энергия s-связывающей МО, преимущественно локализованной на лигандах, в основном определяется энергетическим положением атомных орбиталей лигандов, то энергия гипервалентной Х-А-Х связи тем больше, чем больше энергетический зазор между исходными атомными орбиталями центрального атома и лигандов, т. е. чем больше разница в относительных электроотрицательностях между А и Х.
Хd- показывает, что выигрыш в энергии системы по сравнению с исходными атомами, зависит от энергетического положения s-связывающей МО по отношению к энергии валентной орбитали центрального атома. Поскольку энергия s-связывающей МО, преимущественно локализованной на лигандах, в основном определяется энергетическим положением атомных орбиталей лигандов, то энергия гипервалентной Х-А-Х связи тем больше, чем больше энергетический зазор между исходными атомными орбиталями центрального атома и лигандов, т. е. чем больше разница в относительных электроотрицательностях между А и Х.
Таким образом, электронное строение и свойства соединений непереходных элементов в рамках метода ГВС можно приближенно описать на основе единой системы МО, являющихся индивидуальной совокупностью трех типов взаимодействий – CV, HV и OS.
Пример 1. Описать электронное строение и структуру фторидов ксенона: XeF2, XeF4, XeF6 и XeF8.
Решение. Валентными орбиталями, участвующими в образовании химических связей фторидов ксенона являются 5s2- и 5р6-орбитали центрального атома Xe и 2р5-орбитали фторидных лигандов. В результате взаимодействия заполненной электронами px-орбитали Xe с частично заполненными px-орбиталями двух атомов фтора образуется трехцентровая четырехэлектронная гипервалентная связь (HV-1):

Схема 19. Молекулярные орбитали XeF2.
Электронное строение молекул тетрафторида XeF4 и гексафторида XeF6 описывается образованием соответственно двух и трех HV-1 связей в результате взаимодействия валентных px, py и px, py, pz орбиталей атома Xe с соответствующими орбиталями фторидных лигандов:

Схема 20. Гипервалентные связи в молекулах XeF4 и XeF6.
Образование линейных трехцентровых HV-1 связей с участием р-орбиталей ксенона определяет линейную, плоскоквадратную и октаэдрическую структуру молекул XeF2, XeF4 и XeF6.
Наряду с валентными 5р-орбиталями, в образовании гипервалентных связей могут участвовать и заполненные 5s-орбитали атома ксенона. Взаимодействие их с р-орбиталями дополнительных двух атомов фтора определяет существование молекулы XeF8, электронное строение которой характеризуется наличием трех HV-1 и одной HV-2 связей. Геометрическое строение молекулы XeF8 – квадратная антипризма – соответствует наиболее симметричному расположению 8 лигандов вокруг атома ксенона. В связи с меньшей прочностью связей HV-2 по сравнению с HV-1 наименее устойчивым среди фторидов ксенона является XeF8.
Пример 2. Описать электронное строение полииод-инов [In]-, образующихся в водных растворах при взаимодействии иодидов щелочных металлов с молекулярным иодом: I- + n/2I2 = [In]-. С каким максимальным значением n возможно образование полииодид-ионов?
Решение. Электронное строение полииодид-ионов [In]- может быть описано на основе последовательного образования гипервалентных связей в результате взаимодействия каждой из заполненных электронами валентных 5p- и 5s-орбиталей центрального иодид-иона I- с частично заполненными р-орбиталями двух атомов иода. Это определяет следующий ряд полииодид-ионов: [I3]-, [I5]- и [I7]- - с одной, двумя и тремя гипервалентная HV-1 связями за счет взаимодействия 5рx, 5py и 5pz-орбиталей центрального иодид-иона с двумя р-орбиталями атомов иода, и [I9]-, характеризующийся тремя HV-1 и одной HV-2 связями в результате дополнительного взаимодействия 5s-орбитали иодид-иона с двумя р-орбиталями атомов иода. Таким образом максимальное число n для полииодид ионов не превышает 9.
Возможность образования и относительная устойчивость гипервалентных связей полииодидных ионов определяется более высокой энергией заполненных электронами валентных 5s- и 5p-орбиталей центрального иодидного иона по сравнению с частично заполненными 5p-орбиталями атомов иода, выступающих в качестве лигандов.
Пример 3. На примере соединений халькогенов обосновать применимость эмпирического правила «N-2» для наиболее устойчивых степеней окисления элементов в их соединениях. С чем связано исключение из этого правила для соединений кислорода?
Решение. В соответствии с эмпирическим правилом «N-2» для р-элементов 6 группы (халькогенов) наиболее устойчивыми являются соединения со степенями окисления +6, +4, +2, 0 и –2. Наличие у атомов халькогенов (ns2np4) двух неспаренных электронов на р-орбиталях определяет возможность образования ими с партнерами двух ковалентных двухцентровых двухэлектронных химических связей. Причем, поскольку такие связи могут быть образованы независимо от соотношения относительных электроотрицательностей элемента Э и партнера Х, то для всех элементов 6 группы характерно образование соединений как с формально положительной +2 (OF2, SO, SeCl2, TeI2), так и отрицательной –2 (халькогениды - Na2O, K2S, CaSe, BaTe) степенью окисления элемента. В тоже время, дополнительное образование одной (HV-1) или двух (HV-1 + HV-2) трехцентровых гипервалентных связей с участием электронных пар на валентных np и ns-орбиталях атомов халькогенов возможно только с более электроотрицательными партнерами. Как следствие этого, в соединениях с гипервалентными химическими связями HV-1 и HV-2 формальная степень окисления элемента может быть только положительной: +4 (SF4,, SeCl4, TeCl4) и +6 (SF6, SeF6, TeF6).
Так как гипервалентные связи являются относительно устойчивыми только при взаимодействии центрального атома с более электроотрицательными лигандами, а кислород сам является одним из наиболее электроотрицательных элементов, то образование устойчивых соединений кислорода в степени окисления +4 и +6 не возможно.
Водородная связь
 Уникальность электронного строения атома водорода, характеризующегося отсутствием внутренних электронов, определяет его способность образовывать особый тип химической связи с атомами наиболее электроотрицательных элементов – водородной связи. При этом атом водорода, связанный полярной ковалентной двухэлектронной связью с атомом А в соединении ХА-Н, образует дополнительную водородную связь с атомом В соединения ВУ, характеризующегося наличием неподеленной электронной пары: ХА-Н×××ВУ. Причем, образующие водородную связь молекулы ХАН и ВУ могут быть как разными (F-H×××NH3), так и одинаковыми (F-H×××FH, H2N-H×××NH3). Более того, наряду с межмолекулярной водородной связью, при взаимодействии группировок –АН и –В, входящих в состав одной молекулы, может образовываться и внутримолекулярная водородная связь.
Уникальность электронного строения атома водорода, характеризующегося отсутствием внутренних электронов, определяет его способность образовывать особый тип химической связи с атомами наиболее электроотрицательных элементов – водородной связи. При этом атом водорода, связанный полярной ковалентной двухэлектронной связью с атомом А в соединении ХА-Н, образует дополнительную водородную связь с атомом В соединения ВУ, характеризующегося наличием неподеленной электронной пары: ХА-Н×××ВУ. Причем, образующие водородную связь молекулы ХАН и ВУ могут быть как разными (F-H×××NH3), так и одинаковыми (F-H×××FH, H2N-H×××NH3). Более того, наряду с межмолекулярной водородной связью, при взаимодействии группировок –АН и –В, входящих в состав одной молекулы, может образовываться и внутримолекулярная водородная связь.
В качестве атомов А и В выступают атомы наиболее электроотрицательных элементов – чаще всего F, O и N. Энергия водородной связи меньше (10-80 кДж/моль), а длина больше (на ~0.1 нм) по сравнению с энергией и длиной обычных двухэлектронных ковалентных химических связей и зависит как от природы взаимодействующих атомов А и В, так и от электронной структуры соединений ХАН и ВУ в целом. С увеличением электроотрицательности атомов А и В энергия водородных связей в целом возрастает – например, для димеров F-H×××FH, HO-H×××OH2 и H2N-H×××NH3 энергия водородной связи соответственно составляет 28, 23 и 17 кДж/моль. Если атомы А и В различны, то водородная несимметрична – длины связей водорода с атомами А и В также различны; если же атомы А и В одинаковы, то водородная связь может быть как несимметричной А-Н×××А, так и симметричной А-Н-А с равными длинами связи. Такие симметричные водородные связи отличаются повышенной энергией – например, энергия водородной связи в симметричном дифторогидрогенат- ионе [F-H-F]- составляет 168 кДж/моль.
Важным свойством водородной связи, указывающим на отличие ее природы от электростатического взаимодействия между полярными молекулами, является направленность и насыщаемость водородной связи – при взаимодействии молекул ХАН и ВУ каждый атом водорода может участвовать в образовании не более одной водородной связи ХА-Н×××ВУ, причем, трехцентровый фрагмент А-Н×××В чаще всего имеет линейный характер. Образование водородной связи приводит к делокализации электронной плотности – ее направленному сдвигу от молекулы донора ВУ к акцептору ХАН, охватывающему все атомы и химические связи взаимодействующих молекул. Для простоты рассмотрим характер изменения электронной плотности в трехцентровом фрагменте А-Н×××В. В процессе образования водородной связи электронный заряд на атоме водорода смещается к атому А, что приводит с одной стороны к частичному освобождению s-орбитали водорода для переноса электронного заряда неподеленной пары атома В, а с другой – «оголяет» протон водорода и, как следствие этого, в результате уменьшения отталкивания электронной оболочки атома В обеспечивает достаточно «тесный» контакт атомов А и В. Поскольку такое «оголение» протона возможно только при отсутствии внутренних электронов, то образование такого типа химической связи возможно только для атома водорода.
Электронная структура водородной связи в трехцентровом фрагменте А-Н×××В может быть рассмотрена в рамках метода ГВС. Исходными орбиталями, участвующими в трехцентровом взаимодействии являются: 1s1 орбиталь центрального атома Н; валентная занятая одним электроном орбиталь s-типа атома А (YA), за счет которой в молекуле ХА-Н реализована двухцентровая двухэлектронная связь А-Н; валентная занятая электронной парой орбиталь атома В (YB). Взаимодействие этих орбиталей приводит к образованию трех МО - s-связывающей, несвязывающей (n) и s*-разрыхляющей:
Y(s) = c1YA + c2Y(1s) + c3YB,
Y(n) = c4YA + c5Y(1s) – c6YB,
Y(s*) = c7YA – c8Y(1s) + c9YB,
заселение которых 4 электронами определяет электронное строение трехцентрового фрагмента А-Н×××В (s)2(n)2(s*)0 и показывает понижение энергии системы за счет заселения s-связывающих трехцентровых МО. Для симметричных водородных связей - например, [F-H-F]- - несвязывающая МО не содержит валентной 1s орбитали атома Н: Y(n) = c4YF1 – c6YF2 и полностью аналогична несвязывающей МО для типичной гипервалентной HV-2 связи (схема 19).
Описание водородной A-H×××В связи как трехцентровой четырехэлектронной гипервалентной связи позволяет объяснить ее специфические особенности: пониженная энергия водородной связи по сравнению с обычными двухцентровыми двухэлектронными ковалентными связями связано с ее пониженной кратностью (К = 0.5); поскольку гипервалентные связи образуются только при значительной разнице в электроотрицательностях между центральным атомом и лигандами, то водородная связь характерна для соединений с наиболее электроотрицатльными атомами А и В, причем с ростом их электроотрицательности энергия водородной связи увеличивается.
Водородная связь весьма распространена и играет важную роль во многих физико-химических процессах: ассоциации и самоионизации молекул, процессах растворения и образования кристаллогидратов, электролитической диссоциации и др. Например, любые молекулы, способные к образованию межмолекулярных водородных связей, в конденсированном (твердом и жидком) состоянии образуют ассоциаты, структура и свойства которых определяется характером водородных связей.
Пример 1. Охарактеризовать структуру фтороводорода, ортоборной кислоты и воды в конденсированном состоянии. Как и почему изменяется плотность воды в интервале от 0 до 100 оС?
Решение. Структурные характеристики HF, H3BO3 и H2O в конденсированной состоянии определяются ассоциацией индивидуальных молекул за счет образования межмолекулярных водородных связей:
- образование молекулой фтороводорода двухводородных связей (×××F-H×××) определяет ассоциацию молекул HF в твердом, жидком и даже газообразном состоянии в зигзагообразные цепочки (HF)n;
- ассоциация молекул борной кислоты за счет трех водородных связей приводит к слоистой кристаллической решетке;
-  наличие двух электронных пар, локализованных на атомах О, и двух атомов Н определяет трехмерную систему межмолекулярных водородных связей молекул воды в конденсированном состоянии - каждая молекула связана 4 направленными к вершинам тетраэдра межмолекулярными водородными связями, что приводит к обраразованию гексагональной кристаллической решетки с большим объемом пустот.
наличие двух электронных пар, локализованных на атомах О, и двух атомов Н определяет трехмерную систему межмолекулярных водородных связей молекул воды в конденсированном состоянии - каждая молекула связана 4 направленными к вершинам тетраэдра межмолекулярными водородными связями, что приводит к обраразованию гексагональной кристаллической решетки с большим объемом пустот.


«Рыхлая» кристаллическая решетка определяет относительно низкую плотность льда (0.92 г/см3). При плавлении дальний порядок, существующий в кристалле, нарушается – часть молекул воды заполняет пустоты и плотность жидкости вплоть до 4 оС увеличивается и достигает значения 1.00 г/см3. Дальнейшее увеличение температуры от 4 до 100 оС сопровождается уменьшением плотности воды до значения 0.95 г/см3 в результате ее термического расширения. Пониженная плотность льда по сравнению с жидкой водой позволяет льду плавать на поверхности водоемов и предохраняет их от полного промерзания до дна.
Пример 2. Обосновать аномально высокие температуры плавления и кипения воды по сравнению как с другими водородными соединениями халькогенов, так и с аммиком и фтороводородом:
| H2O | H2S | H2Se | H2Te | NH3 | HF | |
| Tпл., оС | -85.6 | -65.7 | -51 | -77.8 | -83.4 | |
| Tкип., оС | -60.4 | -41.4 | -2 | -33 | 19.5 |
Решение. Аномально высокие температуры плавления и кипения воды связаны с наличием в твердом и жидком состоянии трехмерной структуры в результате образования каждой молекулой четырех межмолекулярных водородных связей. Поскольку электроотрицательность всех халькогенов по сравнению с кислородом значительно меньше, то образование водородных связей для H2S, H2Se и H2Te не характерно, что и приводит к более низким температурам их плавления и кипения. В случае аммиака (одна неподеленная электронная пара) и фтороводорода (один атом водорода) каждая молекула участвует в образовании только двух межмолекулярных водородных связей, что приводит к их цепочечной структуре и определяет более низкие температуры плавления и кипения по сравнению с трехмерно структурированной водой.
Растворимость химических соединений в воде также в значительной степени контролируется эффективностью образования межмолекулярных водородных связей между молекулами воды и растворяемым веществом.
Пример 3. Почему температура плавления и растворимость в воде орто-нитрофенола (t = 45 оС, s = 0.21 г/100 мл) меньше чем у пара-нитрофенола (t = 114 оС, s = 1.6 г/100 мл)?

 Решение. Наличие в молекуле орто-нитрофенола двух близко расположенных акцепторной O-H и донорной O-N группировки определяет образование внутримолекулярной водородной связи, что предотвращает образование межмолекулярных водородных связей. Для пара-нитрофенола образование внутримолекулярной водородной связи не возможно из-за большой удаленности донорной и акцепторной группировок. Как следствие этого, молекулы пара-нитрофенола образуют межмолекулярные водородные связи, что и определяет более высокую температуру плавления. Возможность образования молекулами пара-нитрофенола межмолекулярных водородных связей с молекулами растворителя способствует их лучшей растворимости в воде.
Решение. Наличие в молекуле орто-нитрофенола двух близко расположенных акцепторной O-H и донорной O-N группировки определяет образование внутримолекулярной водородной связи, что предотвращает образование межмолекулярных водородных связей. Для пара-нитрофенола образование внутримолекулярной водородной связи не возможно из-за большой удаленности донорной и акцепторной группировок. Как следствие этого, молекулы пара-нитрофенола образуют межмолекулярные водородные связи, что и определяет более высокую температуру плавления. Возможность образования молекулами пара-нитрофенола межмолекулярных водородных связей с молекулами растворителя способствует их лучшей растворимости в воде.
Кристаллизация многих солей происходит с образованием кристаллогидратов. Удерживание молекул воды в кристаллической решетке гидратированных солей происходит как благодаря ион-дипольному взаимодействию, так и в результате образования прочных водородных связей. Например, в кристаллической решетке медного купороса CuSO4×5H2O четыре молекулы воды координированы к иону меди(II), а пятая удерживается в кристалле с помощью четырех водородных связей, образуемых с двумя координированными молекулами воды и двумя сульфат-ионами. Заполняя пустоты в кристаллической решетке, молекулы воды стабилизируют структуру и способствуют уменьшению отталкивания многозарядных ионов. Например, FeSiF6×6H2O и Na2XeO6×6H2O – устойчивые кристаллогидраты, а соответствующие безводные соли неизвестны.
Наличие объемной структуры водородных связей в жидкой воде (при плавлении льда разрушается только ~15% всех водородных связей) наряду с большой величиной дипольного момента молекулы воды (m = 1.84 D) обуславливает высокое значение диэлектрической проницаемости воды e = 80 при 25 оС. Это определяет значительное уменьшение кулоновского взаимодействия между заряженными ионами и приводит к протеканию процесса электролитической диссоциации химических соединений с преимущественно ионным характером химической связи.
Пример 4. В каком растворителе и почему лучше растворим сульфат натрия – в воде, или жидком аммиаке?
Решение. Растворимость сульфата натрия, как и других ионных кристаллов, в полярных растворителях тем лучше, чем легче протекает процесс его электролитической диссоциации. Поскольку по сравнению с водой аммиак характеризуется как более низким дипольным моментом молекулы (m = 1.48 D), так меньшей эффективностью межмолекулярных водородных связей, то в результате уменьшения диэлектрической проницаемости (e = 26.7 при –60 оС) жидкого аммиака процесс электролитической диссоциации и, следовательно, растворимость сульфата натрия лучше в воде.
Пример 5. Почему диссоциации в водных растворах для орто-оксибензойной кислоты протекает почти в тридцать раз более эффективно, чем для пара-оксибензойной кислоты?
Решение. Процесс электролитической диссоциации как орто-, так и мета-оксибензойной кислоты обусловлен процессом переноса протона от карбоксильной группы кислоты к молекуле воды в результате образования межмолекулярной водородной связи:

Наряду с межмолекулярной водородной связью с молекулами воды, орто-оксибензойная кислота характеризуются наличием также внутримолекулярной водородной связи, образование которой приводит к смещению электронной плотности от донорной карбоксильной группы к акцепторной окси-группе. В результате этого ионность связи О-Н в карбоксильной группе увеличивается, что и обеспечивает повышение эффективности процесса электролитической диссоциации орто-оксибензойной кислоты по сравнению с пара-изомером.
Особенно важна роль водородных связей в структуре и свойствах компонентов живых организмов – белков и нуклеиновых кислот. Макромолекулы белков, молекулярный вес которых составляет 6×103 - 7×106, образуются в результате дегидратации аминокислот и характеризуются наличием пептидных связей:

В результате образования внутримолекулярных водородных связей:

длинные полипептидные цепи белков закручиваются в спираль, которая обеспечивает прочность и эластичность волокон живых тканей.
 Гены, включающие молекулы дезоксирибонуклеиновой кислоты (ДНК), передают генетическую информацию соответствующим клеткам, которые и синтезируют разнообразные белки с помощью молекул рибонуклеиновой кислоты (РНК). Причем, главную роль в структуре этих молекул, обеспечивающих воспроизведение всего живого, снова играют водородные связи. Основой молекул нуклеиновых кислот являются молекулы сахаров, соединенные фосфатными группами и содержащие в боковой цепи два типа азотистых оснований: пиримидиновые – аденин и гуанин, и пуриновые – тимин и цитазин. Молекулы состоят из двух переплетенных спиралей, связанных водородными связями между парами оснований в отдельных цепях.
Гены, включающие молекулы дезоксирибонуклеиновой кислоты (ДНК), передают генетическую информацию соответствующим клеткам, которые и синтезируют разнообразные белки с помощью молекул рибонуклеиновой кислоты (РНК). Причем, главную роль в структуре этих молекул, обеспечивающих воспроизведение всего живого, снова играют водородные связи. Основой молекул нуклеиновых кислот являются молекулы сахаров, соединенные фосфатными группами и содержащие в боковой цепи два типа азотистых оснований: пиримидиновые – аденин и гуанин, и пуриновые – тимин и цитазин. Молекулы состоят из двух переплетенных спиралей, связанных водородными связями между парами оснований в отдельных цепях.
Схема 21. Строение молекул нуклеиновых кислот.
Стерические требования таковы, что водородная связь образуется, только если она соединяет пиримидиновое основание с пуриновым (два пиримидиновых основания слишком малы, а два пуриновых – слишком велики для того, чтобы связать две цепи). Благодаря высокой избирательности при выборе подходящих партнеров для образования водородных связей обе цепи должны быть комплементарными – каждому основанию одной цепи должно соответствовать строго определенное основание другой цепи (отклонение от этого требования приводят к мутации). В процессе деления клеток двойная спираль полинуклеотидов раскручивается на две отдельные цепи, выступающих в качестве своеобразных матриц, на которых синтезируются новые цепи. Это обеспечивает воспроизведение молекул с характеристической последовательностью азотистых оснований в двух переплетенных спиралях нуклеиновых кислот, что приводит к определенной последовательности аминокислотных остатков в полипептидной цепи белка, синтезируемого в клетке под действием данного гена.
Дата добавления: 2016-06-22; просмотров: 5610;











