Ферменти; будова, властивості, класифікація.
Обмін речовин в організмі живої істоти можна визначити як сукупність всіх хімічних перетворень, яким піддаються сполуки, що надходять ззовні. Ці перетворення включають всі відомі види хімічних реакцій: міжмолекулярне перенесення функціональних груп, гідролітичне і негідролітичне розщеплювання хімічних зв'язків, внутрішньомолекулярну перебудову та новоутворення хімічних зв'язків і окиснювально-відновні реакції. Такі реакції протікають в організмі з надзвичайно великою швидкістю тільки у присутності каталізаторів. Всі біологічні каталізатори є речовини білкової природи і носять назву ферменти або ензими.
Ферменти не являються компонентами реакцій, а лише прискорюють досягнення рівноваги, збільшуючи швидкість як прямого, так і зворотного перетворення. Прискорення реакції відбувається за рахунок зниження енергії активації того енергетичного бар'єру, який відокремлює один стан системи (початкову хімічну сполуку) від іншого (продукт реакції).
Ферменти прискорюють самі різні реакції в організмі. Так, достатньо проста з погляду традиційної хімії реакція відщеплення води від вугільної кислоти з утворенням СО2 вимагає участі ферменту, оскільки без нього вона протікає дуже повільно. Ця реакція важлива для регулювання рН крові. Завдяки каталітичній дії ферментів в організмі стає можливим протікання таких реакцій, які без каталізатора йшли б в сотні і тисячі разів повільніше.
Властивості ферментів:
1. Вплив на швидкість хімічної реакції: ферменти збільшують швидкість хімічної реакції, але самі при цьому не витрачаються.
Швидкість реакції – це зміна концентрації компонентів реакції в одиницю часу. Якщо вона йде в прямому напрямі, то пропорційна концентрації реагуючих речовин, якщо в зворотному – то пропорційна концентрації продуктів реакції. Відношення швидкостей прямої і зворотної реакцій називається константою рівноваги. Ферменти не можуть змінювати величини константи рівноваги, але стан рівноваги у присутності ферментів настає швидше.
2. Специфічність дії ферментів. У клітинах організму протікає 2-3 тис. реакцій, кожна з яких каталізується певним ферментом. Специфічність дії ферменту – це здатність прискорювати протікання однієї певної реакції, не впливаючи на швидкість інших, навіть дуже схожих.
Розрізняють види специфічності:
Абсолютну – коли фермент каталізує лише одну певну реакцію (аріназа– розщеплювання аргініну)
Відносну – фермент каталізує певний клас реакцій (наприклад, гідролітичне розщеплювання) або реакції за участю певного класу речовин.
Специфічність ферментів обумовлена їх унікальною амінокислотною послідовністю, від якої залежить конформація активного центру, що взаємодіє з компонентами реакції.
Речовина, хімічне перетворення якої каталізується ферментом, носить назву субстрат.
3. Активність ферментів – здатність різною мірою прискорювати швидкість реакції.
Активність залежить в першу чергу від температури. Найбільшу активність той або інший фермент проявляє при оптимальній температурі. Для ферменту живого організму це значення знаходиться в межах (37,0…39,0)°С, залежно від виду тварини. При пониженні температури сповільнюється броунівський рух, зменшується швидкість дифузії і, отже, сповільнюється процес утворення комплексу між ферментом і компонентами реакції (субстратами). В разі підвищення температури вище 40…50°С молекула ферменту, яка являється білком, піддається процесу денатурації. При цьому швидкість хімічної реакції помітно падає (рис. 2).
|
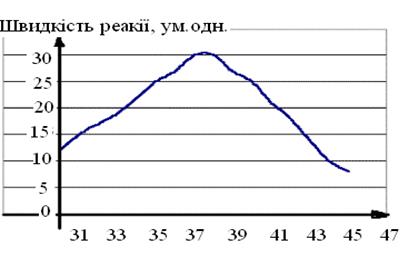
Рис. 2. Залежність швидкості реакції, яку каталізує фермент організму людини, від температури. Максимальна швидкість відповідає температурі тіла людини.
Активність ферментів залежить також від рН-середовища. Для більшості з них існує певне оптимальне значення рН, при якому їх активність максимальна. Оскільки в клітині містяться сотні ферментів і для кожного з них існують свої межі оптимуму рН-середовища, тому зміна рН – це один з важли-вих чинників регуляції ферментативної активності. Так, в результаті однієї хімічної реакції за участю певного ферменту, рН оптімум якого лежить в межах 7,0…7,2, утворюється продукт, який є кислотою. При цьому значення рН зміщується в область 5,5...6,0, активність ферменту різко знижується, швидкість утворення продукту сповільнюється, але при цьому активізується інший фермент, для якого ці значення рН оптимальні і продукт першої реакції піддається подальшому хімічному перетворенню. (Або наприклад: пепсин і трипсин).
Хімічна природа ферментів. Будова ферменту. Всі ферменти – це білки з молекулярною масою від 15000 до декількох млн. Да. По хімічній будові розрізняють прості ферменти (складаються тільки з АК) і складні ферменти (мають небілкову частину або простетичну групу). Білкова частина носить назву – апофермент, а небілкова, якщо вона пов'язана ковалентно з апоферментом, називається кофермент, а якщо зв'язок нековалентний (іонний, водневий) – кофактор. Функції простетичної групи: участь в акті каталізу, здійснення контакту між ферментом і субстратом, стабілізація молекули ферменту в просторі.
В ролі кофактора звичайно виступають неорганічні речовини – іони цинку, міді, калія, магнію, кальцію, заліза, молібдену.
Коферменти можна розглядати як складову частину молекули ферменту. Це органічні речовини, серед яких розрізняють: нуклеотиди (АТФ, УМФ та ін.), вітаміни або їх похідні (ТДФ – з тіаміну (В1), ФМН – з рибофлавіну (В2), коэнзим А – з пантотенової кислоти (В3), НАД і ін.) і тетрапиррольні коферменти – геми.
В процесі реакції каталізу в контакт з субстратом вступає не вся молекула ферменту, а певна її ділянка, яка називається активним центром. Ця зона молекули не складається з послідовності амінокислот, а формується при скручуванні білкової молекули в третинну структуру. Окремі ділянки амінокислот зближуються між собою, утворюючи певну конфігурацію активного центру. Важлива особливість структури активного центру – його поверхня комплементарна поверхні субстрату, тобто залишки амінокислот цієї зони ферменту здатні вступати в хімічну взаємодію з певними групами субстрату. Можна уявити, що активний центр ферменту співпадає із структурою субстрату як ключ і замок.
У активному центрі розрізняють дві зони: центр зв’язування, відповідальний за приєднання субстрату і каталітичний центр, що відповідає за хімічне перетворення субстрату. До складу каталітичного центру більшості ферментів входять такі амінокислоти, як Сер, Цис, Гис, Тир, Ліз. Складні ферменти в каталітичному центрі мають кофактор або кофермент.
Крім активного центру ряд ферментів забезпечений регуляторним (алостеричним) центром. З цією зоною ферменту взаємодіють речовини, що впливають на його каталітичну активність.
Механізм дії ферментів:
Реакція каталізу складається з трьох послідовних етапів.
1. Утворення фермент-субстратного комплексу при взаємодії через активний центр.
2. Зв’язування субстрату відбувається в декількох точках активного центру, що приводить до зміни структури субстрату, його деформації за рахунок зміни енергії зв'язків в молекулі. Це друга стадія і називається вона активацією субстрату. При цьому відбувається певна хімічна модифікація субстрату і перетворення його в новий продукт або продукти.
3. В результаті такого перетворення нова речовина (продукт) втрачає здатність утримуватися в активному центрі ферменту і фермент-субстратний, вірніше вже фермент-продуктний комплекс дисоціює (розпадається).
Ферментативні регулятори – це речовини, що змінюють швидкість ферментативного каталізу і регулюючі за рахунок цього метаболізм. Серед них розрізняють інгібітори– уповільнюючі швидкість реакції і активатори– прискорюючі ферментативну реакцію.
Залежно від механізму гальмування реакції розрізняють конкурентні і неконкурентні інгібітори. Будова молекули конкурентного інгібітору схожа із структурою субстрату і співпадає з поверхнею активного центру як ключ із замком (або майже співпадає). Ступінь цієї схожості може навіть бути вище, чим з субстратом.
Другий вид інгібіторів – неконкурентні. Вони взаємодіють з ферментом поза активним центром і надлишок субстрату не впливає на їх здатність інгібірування, як у випадку з конкурентними інгібіторами. Ці інгібітори взаємодіють або з певними групами ферменту або, найчастіше, з регуляторним центром, що знижує зв’язуючу здатність активного центру. Власне процес –- це повне або часткове придушення активності ферменту при збереженні його первинної і просторової структури.
Розрізняють також зворотнє і незворотнє інгібірування. Незворотні інгібітори інактивують фермент, утворюючі з його амінокислотами або іншими компонентами структури хімічний зв'язок. Звичайно, це ковалентний зв'язок з| однією з ділянок активного центру. Такий комплекс практично не дисоціює у фізіологічних умовах. У іншому випадку інгібітор порушує конформаційну структуру молекули ферменту, викликаючи його денатурацію.
Дія зворотних інгібіторів може відбуватися при надлишку субстрату або під дією речовин, що змінюють хімічну структуру інгібітору. Конкурентні і неконкурентні інгібітори відносяться в більшості випадків до оборотних.
Крім інгібіторів відомі ще активатори ферментативного каталізу. Вони захищають молекулу ферменту від інактиваційних дій, утворюють із субстратом комплекс, який активніше зв'язується з активним центром ферменту, а також взаємодіючи із ферментом, що має четвертинну структуру, роз'єднують його субодиниці і тим самим відкривають доступ субстрату до активного центру.
Розподіл ферментів в організмі. Ферменти, що беруть участь в синтезі білків, нуклеїнових кислот і ферменти енергетичного обміну присутні у всіх клітинах організму. Але клітини, які виконують спеціальні функції, містять і спеціальні ферменти. Так, клітини острівців Лангерганса в підшлунковій залозі містять ферменти, що каталізують синтез гормонів інсуліну і глюкогону. Ферменти, які властиві тільки клітинам певних органів, називають органоспецифічними: аргіназа і урокіназа – печінка, кисла фосфатаза – простата. По зміні концентрації таких ферментів в крові судять про наявність патології в даних органах.
У клітині окремі ферменти розподілені по всій цитоплазмі, інші вбудовані в мембрани мітохондрій і ендоплазматичного ретикулума. Такі ферменти утворюють компартменти,в яких відбуваються визначені, тісно зв'язані між собою етапи метаболізму.
Багато ферментів утворюються в клітинах і секретуються в анатомічні порожнини в неактивному стані – це проферменти. Часто у вигляді проферментів утворюються протеолітичні ферменти (що розщеплюють білки). Потім під впливом рН або інших ферментів і субстратів відбувається їх хімічна модифікація і активний центр стає доступним для субстратів.
Існують також ізоферменти– ферменти, що відрізняються по молекулярній структурі, але виконують однакову функцію.
Номенклатура і класифікація ферменті. Назва ферменту формується з наступних частин:
1. назва субстрату, з яким він взаємодіє;
2. характеру реакції, що каталізує;
3. найменування класу ферментів (але це необов'язково);
4. суфіксу -аза.
Оскільки вже відомо близько 3 тис. ферментів, їх необхідно класифікувати. В даний час прийнята міжнародна класифікація ферментів, в основу якої покладений тип реакції, що каталізує. Виділяють 6 класів, які в свою чергу діляться на ряд підкласів:
1. Оксидоредуктаза. Каталізують окиснювально-відновні реакції. Діляться на 17 підкласів. Всі ферменти містять небілкову частину у вигляді гема або похідних вітамінів В2, В5. Субстрат, що піддається окисненню, виступає як донор водню. Дегідрогеназа відщеплює від одного субстрату Гідроген і переносить на інші субстрати. Коферменти НАД, НАДФ, ФАД, ФМН акцептують на собі відщеплений ферментом Гідроген, перетворюючись при цьому на відновлену форму (НАДН, НАДФН, ФАДН) і переносять до іншого фермент-субстратного комплексу, де його і віддають.
2. Трансферази – каталізують перенесення різних радикалів від молекули донора до молекули акцептору.
3. Гідролази – каталізують реакції гідролізу, тобто розщеплювання речовин з приєднанням по місцю розриву зв'язку води. До цього класу відносяться, переважно, травні ферменти. Вони однокомпонентні (не містять небілкової частини)
4. Ліази– каталізують реакції розщеплювання молекул без приєднання води. Ці ферменти мають небілкову частину у вигляді тіамінпірофосфату (В1) і пірідоксальфосфату (В6).
5. Ізомерази– каталізують реакції ізомерізації.
6. Лігази (синтетази)–каталізують реакції синтезу складніших речовин із простих. Такі реакції йдуть з витратою енергії АТФ. До назви таких ферментів додають «синтетаза».
Використання ферментів в харчовій промисловості. У харчовій промисловості ферменти використовуються для одержання продуктів із заданими властивостями. При цьому можуть використовуватися мікробні ферменти; ферменти, виділені з деяких органів, наприклад, з печінки, підшлункової залози, шлунка. Більш зручним і ефективним є використання іммобілізованих ферментів.
Іммобілізовані ферменти. Іммобілізація ферментів – це включення об'єкта (ферменту) в ізольовану фазу, що відділена від фази вільного розчину, але здатна обмінюватися з нею молекулами.
Іммобілізовані ферменти одержують шляхом зв'язування з носіями розчинних ферментів або клітин, що володіють ферментативною активністю, тобто роблять сорбцію ферменту на носії і включення в структуру носіїв – гелів.
Іммобілізація наближає умови їхнього функціонування до природного.
Перевага їхнього використання полягає в тому, що їх можна видаляти з реакційного середовища, тобто контролювати хід реакції і багаторазово його використовувати. Використання іммобілізованих ферментів дозволяє проводити кожен процес безупинно, пропускаючи розчини субстратів через реактори з іммобілізованими ферментами.
Іммобілізовані ферменти мають високу каталітичну активність. Її можна змінювати, змінюючі спосіб зв'язування і вид носія. Продукти реакції не забруднюються кристалічними ферментами.
За допомогою іммобілізованих ферментів одержують амінокислоти, ароматичні кислоти, цукри, органічні розчинники, антибіотики. Також їх використовують для очищення стічних вод і водойомів.
У промисловості застосовують ферменти мікробного походження: протеолітичні, ліполітичні, амілолітичні, гідролази, що розщеплюють пектин, целюлозу і геміцелюлозу.
Характеристика оксидоредуктаз і використання ферментів у виробництві харчової продукції. Глюкозооксидаза є аеробною дегідрогеназою. Молекула ферменту у якості коферменту містить дві молекули ФАД (флавінаденіндинуклеотид). Вона каталізує відщеплення Н2 від субстрату і перенос його на О2 повітря з утворенням перекису водню. Субстратом є глюкоза, що перетворюється в глюконову кислоту, а перекис водню, що утворився, розщеплюється каталазою на воду і атомарний Оксиген. Глюкозооксидаза синтезується цвілевими грибами.
Цей фермент широко використовується в харчовій промисловості, а також у клінічній хімії для аналізів. Глюкозооксидаза дозволяє видаляти Оксиген і глюкозу з субстратів. Вона використовується для видалення Оксигену з тих харчових речовин, фарбування і аромат яких погіршуються в результаті окисних процесів (пиво, фруктові соки, продукти, що містять жири).
Цей фермент використовують також у тих випадках, коли продукти піддають висушуванню, у ході якого відбувається взаємодія глюкози з білками з утворенням темнопофарбованих продуктів (реакція Майяра). Це має місце при одержанні яєчного і молочного порошку.
У харчовій промисловості глюкозооксидаза як ендогенний фермент цвілевих грибів знаходить застосування при ферментації глюконової кислоти для одержання D-глюконата кальцію.
Ксантиоксидаза каталізує окиснювання різних за хімічною природою субстратів, наприклад, ксантину і формальдегідів. Ця реакція має низьку специфічність. Як акцептор електронів виступає Оксиген повітря. Донором електронів є формальдегід. Як індикатор використовується метиленовий синій. Ця реакція використовується в молочній промисловості для тестування сирого і пастеризованого молока. У результаті достатньої пастеризації відбувається денатурація ксантиноксидази і знебарвлення метиленового синього не відбувається.
Дифенолоксидаза бере участь в окиснюванні тирозину, фенолу, крезолу. Кінцевими продуктами є темнозабарвлені сполуки – меланіни. Фермент виявлений у грибах, картоплі, фруктах. Функціональною групою фенолоксидази є Сu. Важливе значення мають інгібітори цього ферменту, тому що ферментативне побуріння фруктів, соків і інших рослинних матеріалів при їхній переробці є великою проблемою.
Процес потемніння фруктів, соків, продуктів їхньої переробки під впливом дифенолоксидази може бути уповільнений вітаміном С, двоокисом сірки, сульфітом натрію, додаванням повареної солі. Зменшують активність цього ферменту попередня теплова обробка овочів і фруктів, зокрема, бланшування. У ряді випадків дія дифенолоксидази призводить до появи бажаного фарбування, аромату харчових продуктів, наприклад, при ферментації чаю.
Аскорбатоксидаза діє на аскорбінову кислоту, тобто окисляє її в дегідроаскорбінову кислоту. Цей фермент виявлений у багатьох вищих рослинах. Він містить Сu як функціональну групу, що змінює свою валентність у ході каталізу.
Через її дію відбувається руйнування вітаміну С при технологічній обробці. Інгібіторами цього ферменту є деякі амінокислоти (гліцин, цистеїн, аспарагінова і глутамінова кислоти), карбонові й оксикарбонові кислоти (щавлева, лимонна, винна), пектини, флавоноїди і дубильні речовини, кверцитин, антоціани, катехіни. Аскорбатоксидаза при технологічній обробці продуктів не тільки зменшує вміст аскорбінової кислоти, а і впливає на фарбування й аромат соків.
Каталаза – оксидоредуктаза – дегідрує молекулу перекису водню з утворенням води й атомарного оксигену. Як функціональну групу містить ферринпротопорферин ІХ. Молекула ферменту містить чотири гемінові групи, кожна з яких зв'язана з білком. Каталаза інгібується речовинами, що утворюють комплекси з центральним атомом заліза, наприклад, ціанідом, сульфідом, фторидом, CO, NO, ціанамідом і ін. Виявлена у всіх клітинах з аеробним типом обміну речовин. У харчовій промисловості використовують її препарати з печінки і цвілевих грибів у тих випадках, коли спочатку проводиться обробка перекисом водню, а потім він повинен бути вилучений. Наприклад, при пастеризації і стерилізації молока, при відбілюванні волосся, шкір, дезінфекції хірургічного матеріалу.
Пероксидаза сприяє розщепленню перекисів. У її складі, у залежності від джерела, міститься або червоний, або зелений гемін. Пероксидаза з хрону відносно стійка при нагріванні. Прогрівання ферменту при 850С на протязі 30 хвилин приводить до втрати лише половини активності. Її активність гальмують солі важких металів. Використовується для оцінки якості процесу пастеризації. Її достатність визначається за активністю цього ферменту. При ферментації чаю і тютюну цей фермент сприяє утворенню забарвлених і ароматичних компонентів.
Ліпоксигеназа каталізує реакцію: ненасичена жирна кислота + О2 ® перекис ненасиченої жирної кислоти. Характеризується високою специфічністю і діє лише на ненасичені жирні кислоти, що знаходяться в цис-формі. Лінолева, ліноленова і арахідонова кислоти окиснюються з однаковою швидкістю. Містяться в пшениці, насінні олійних культур, бобових, люцерні, соєвому борошні. При переробці харчових продуктів використовують інгібітори ліпоксигенази, що взаємодіють з вільними радикалами, що утворюються як проміжні продукти при дії цього ферменту на ненасичені жирні кислоти. Цей фермент руйнує каротин, ароматичні сполуки продуктів. Він сприяє прогірканню жирів. При використанні ліпоксигенази в хлібопечінні поліпшується колір м'якушки і збільшується обсяг хліба.
Ліпаза відноситься до гідролаз. Вона каталізує розщеплення ефірів гліцеролу і вищих жирних кислот. Причому швидкість розщеплення залежить від довжини ланцюга жирних кислот. Джерелом для одержання промислових препаратів ліпази є підшлункова залоза, цвілеві гриби, молоко. Активаторами ліпази є солі жовчних кислот, особливо таурохолат. У молоці ліпаза сприяє утворенню ароматичних речовин, а ліпаза пшениці і інших злаків сприяє псуванню борошна. Мікробні препарати ліпази використовуються для гідролізу жирів у тих випадках, коли необхідне омилення при збереженні біологічно активних жиророзчинних речовин (наприклад, токоферолу).
Пектиностераза каталізує розщеплення пектину з утворенням метанолу і пектата. Фермент активується іонами Na+ і Ca2+. Пектиностераза володіє високою субстратною специфічністю, гідролізуючи майже винятково метильні групи пектинових сполук. Вона є важливим складним компонентом ферментних препаратів, що використовуються для освітлення фруктових і виноградних соків, а також для одержання низькомолекулярних пектинів, використовуваних при виготовленні желе. Цей фермент разом з іншими ферментами відіграє важливу роль при дозріванні фруктів і ягід, сушінню льна, коноплі, ферментації чаю і тютюну.
Глікозидази каталізують розщеплення олігосахаридів і глікозидів. Вони каталізують гідроліз і трансглікозидування, що відіграє важливу роль при синтезі полісахаридів у рослинах. Їх одержують у промислових умовах із пророслого ячменя. Глікозидази поділяють на кілька типів. Специфічність цих типів визначається розміром кільця гелікона, конфігурацією ОН- груп у кільці і конфігурацією глікозидного гідроксилу. До них відносяться: a-Д-глікозидаза, b-Д-глікозидаза, a-Д-галактозидаза та ін. a-Д-глікозидаза не має промислового значення. b-Д-глікозидаза сприяє видаленню гіркоти із соків цитрусових, а також сприяє звільненню з b-глікозидів ароматичних компонентів.
Гліканази відрізняються від глікозидаз більшою довжиною ланцюга субстратів, на які вони діють. На основі субстратної специфічності розрізняють наступні важливі гліканази: a-амілаза (субстрат - крохмаль, декстрини); b-амілаза (субстрат - крохмаль, декстрини); глюкоамілаза (субстрат - крохмаль, декстрини, мальтоза); інулаза (субстрат - інулін); полігалактуроназа (субстрат - пектин, полігалактуронова кислота).
a -амілаза розщеплює зв'язок -1,4 в полісахаридах, що містять три і більш залишків глюкози. Міститься в слині, соку підшлункової залози, у пророслих зернах, у цвілевих грибах і бактеріях. Для прояву максимальної активності ферменту необхідна присутність кофактора Са2+. Цей фермент сприяє швидкому зменшенню в'язкості крохмального клейстеру, тому його називають декстриногенною амілазою. Використовується при виготовленні крохмальної патоки, сусла і затору.
b - амілаза каталізує розщеплення крохмалю з утворенням мальтози і декстринів. Оскільки під дією b-амілази відбувається звільнення мальтози з амілази й амілопектину, її називають цукровою амілазою. Міститься у вищих рослинах. Джерелами ферменту є ячмінь, жито, пшениця, соєві боби. Використовується у виробництві сусла і затору, крохмальної патоки і як хлібопекарський поліпшувач. Крім того, із крохмалю за допомогою амілаз готують сиропи, що застосовуютьсяі при виготовленні кондитерських виробів і лікерів.
Глюкоамілаза єдина з всіх амілаз швидко гідролізує крохмаль до глюкози, причому вона гідролізує і a-1,4 і a-1,6 зв'язки. Джерелами цього ферменту є цвілеві гриби. Використовується в спиртовому виробництві.
Застосовуються амілази у пивоварній промисловості. Під дією амілаз перетворюється крохмаль головним чином у мальтозу, якщо як джерело амілази використовується ячмінний солод. При використанні для оцукрювання крохмалю ферментів цвілевих грибів крохмаль розщеплюється до глюкози. Характерне розходження між пивоварним і спиртовим виробництвом полягає в тому, що в пивоварстві солод служить одночасно субстратом і джерелом ферменту, оскільки містить як крохмаль, так і амілази.
Повне розщеплення крохмалю в пивоварстві небажано, оскільки пиво повинно містити ще багато низькомолекулярних продуктів розщеплення крохмалю (декстрини), що сприяють одержанню тонкого смаку і піноутворенню.
У харчовій промисловості амілази із солоду або цвілевих грибів часто додають у борошно, оскільки власна амілазна активність борошна не завжди достатня для утворення необхідної для готування тіста кількості цукру, ступінь бродіння тіста виявляється незначним і не досягається потрібний ступінь пористості хліба. Крім того, із крохмалю за допомогою препаратів амілаз готують солодкі сиропи (патоки), що знаходять застосування у виробництві кондитерських виробів і лікерів. Амілази застосовують і при готуванні солодового оцту.
Широке застосування знаходять амілази у виробництві миючих засобів, паперової і, особливо, в текстильній промисловості для шліхтування з метою зміцнення і розгладження ниток.
Так само виготовляють аппреатуру, що додає готовим тканинам міцність, твердість і глянець. При одержанні біологічно активних миючих засобів у них додають суміш ферментів, що розщеплюють крохмаль, білки і жири.
Інулаза гідролізує b-1,2 зв'язки фруктану в інуліні з утворенням фруктози. Вона має визначене значення при виготовленні горілки з бульб топінамбура (земляної груші).
Полігалактуроназа гідролізує a-1,4 D галактуронидні зв'язки в пектатах і інших полігалактуронідах.
Як джерела полігалактуроназ використовують вищі рослини (помідори, редька, гарбуз, авокадо, боби, морква), цвілеві гриби, дріжджі і бактерії. Мікроорганізми синтезують також ферменти, що розщеплюють пектин, діючі одночасно або послідовно на відповідні субстрати (пектолітичні ферменти).
Температурний оптимум дії пектолітичних ферментів дуже важливий для технології, оскільки освітлення фруктових соків здійснюється найчастіше при підвищених температурах. Активаторами пектолітичних ферментів є хлориди лужних металів.
Ферментологія дає можливість дослідникам впливати на обмін речовин в організмі, а також керувати технологічними процесами в харчовій промисловості. Використовуючи ферменти, що викликають бродіння, людина одержує продукти (наприклад, молочнокислі), що легше, ніж вихідні (молоко), засвоюються організмом.
Як відомо, до надходження на підприємства харчування м'ясо після забою худоби повинне "дозріти", у процесі чого усувається післязабійне задубіння і відбувається ряд інших змін, завдяки чому воно здобуває відповідні органолептичні властивості. "Дозрівання" м'яса триває досить довго, однак за допомогою препаратів деяких ферментів, що синтезують деякі гриби, цей процес можна значно прискорити.
На підприємствах харчування використовують ферменти в якості "пом’якшувачів" м'яса: вони діють на сполучну тканину, що саме і додає твердість продуктові.
Ферменти відіграють важливу роль у збереженні харчової сировини і готової продукції. В одних випадках ферменти мікроорганізмів мають позитивний, в інші – негативний вплив. Так, дріжджі використовують при випічці хліба, виготовленні вин, кефіру, кумису. Псування продуктів також викликають ферменти мікроорганізмів. З метою їх інактивування застосовують нагрівання (стерилізацію, пастеризацію, варіння, жаріння), або створюють середовище, у якому ферменти неактивні. Застосування пестицидів засноване на припиненні дії ферментів-шкідників сільськогосподарських культур.
За допомогою специфічного ферменту видаляють неприємний запах, властивий сої через альдегіди, що містяться в ній. Він перетворює їх у кислоту.
На дії ферментів засноване виробництво тютюну, шкіри й інших галузей промисловості.
В зарубіжній та вітчизняній практиці ферменти широко використовуються в технології переробки сировини, зокрема, при рішенні питань про інтенсифікацію виробництва, збільшення виходу готової продукції з однієї ж і тієї сировини, покращення її якості.
В хлібопекарській і кондитерській промисловості при виробництві хлібобулочних виробів використовуються очищені ферментні препарати, які включені в стандарти на хлібобулочні вироби. Практично всюди закордоном і на Україні близько 75 % всього білого хліба випікається з додаванням амілази пліснявих грибів.
В Японії в хлібопекарській промисловості використовується більше 50 різних ферментних препаратів.
В крохмале-патоковій промисловості застосування ферментів – один з шляхів підвищення виробництва пшеничного, картопляного і кукурудзяного крохмалів. При виробництві пива і хлібного квасу використання ферментних препаратів дозволяє значно зменшити витрати солоду.
В молочній промисловості використання ферментів при виробництві твердих сирів значно прискорює процеси його дозрівання.
В консервній промисловості застосування пектолітичних ферментних препаратів підвищує вихід готової продукції на 15…20 % і сприяє освітленню фруктових соків. Використання при замочуванні бобових і круп амілолітичних ферментів дозволяє скоротити час їх варіння і доведення до готовності на 30 %.
В рибній промисловості протеолітичні ферменти використовуються для прискорення дозрівання оселедців. Для переробки відходів рибної промисловості з метою отримання білкових гідролізатів. В м'ясній промисловості ферменти використовуються для приготування гідролізатів, м'ясних паштетів, паст і екстрактів, полегшення відділення м'яса від кісток, при солінні м'яса, субпродуктів, збільшення термінів зберігання м'ясопродуктів.
Для пом'якшення жорстких тканин, особливо яловичих туш і для виробництва жарених напівфабрикатів використовують ферменти мікробного (терезин), тваринного (пепсин, трипсин, СК ПФ – сухий комплексний препарат із підшлункової залози) і рослинного (папаїн, бромелайн, ферменти із пророслого насіння сої та інші) походження.
Ферменти мікробіального походження сильно впливають на м'язові волокна, ферменти рослинного походження – на елементи сполучної тканини; ферменти тваринного походження займають проміжне положення.
Під дією ферментів в сполучнотканинних прошарках відмічається роз-пад мукополісахаридів, розрихлення, фрагментація і деструкціяколагенових і еластинових волокон. Поряд зі зміною в сполучній тканині відбуваються порушення структури м'язових волокон, що є небажаним, тому що погіршує якість готових виробів.
Важливе значення має також спосіб застосування ферментів, в якізанурюють шматки м'яса або шприцюють їх за допомогою голок і безгольчастим способом шляхом внутрішньовенного введення ферментів перед забоєм тварин.
Широко використовують ферменти для аналізу харчових продуктів. Ці методи ефективніші традиційних хімічних методів. Окрім позитивної ролі ферменти можуть виконувати і негативну роль в ході зберігання і переробки харчової продукції, тобто:
- знижують харчову цінність продуктів в процесі тривалого зберігання;
- дія амілази в крохмальвмісних продуктах викликає деградацію крохмалю, знижує хлібопекарські властивості борошна і, таким чином, якість хліба;
- тривала дія протеолітичних ферментів зменшує вміст в пшениці, житі лізину, що знижує їх біологічну цінність;
- під дією дифенолоксидази відбувається потемніння на повітрі очищеної картоплі;
- під дією оксидаз відбувається потемніння нарізаних яблук і груш.
Дата добавления: 2020-03-17; просмотров: 1278;











