Класифікація протеїногенних амінокислот
| Назва | Структура | Скорочена назва | |||
| I. Неполярні або гідрофобні амінокислоти | |||||
| l. L-Аланін (α –амінопропіонова кислота) | 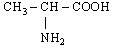
| Ала (Ala) | |||
| 2. L-Валін (α – аміноізовалеріанова кислота) | 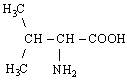
| Вал (Val) | |||
| 3. L-Лейцин (α – аміноізокапронова кислота) | 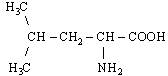
| Лей (Leu) | |||
| 4. L-Ізолейцин (α-аміно-β-метилвалеріанова кислота) | 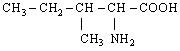
| Иле (Ile) | |||
| 5. L-Триптофан (α-аміно-β-індолілпропіонова кислота) | 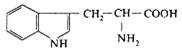
| Три (Try) | |||
| 6. L-Пролін (пірролідин-α-карбонова кислота) | 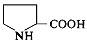
| Про (Pro) | |||
| 7. L-Фенілаланін (α-аміно-β-фенілпропіонова кислота) | 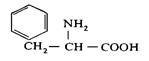
| Фен (Phe) | |||
| 8. L-Метіонін (α-амино-γ-метилтіомасляна кислота) | 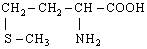
| Мет (Met) | |||
| II. Полярні (гідрофільні) незаряджені амінокислоти | |||||
| 9. Гліцин (амінооцтова кислота) | 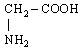
| Гли (Gly) | |||
| 10. L-Серин (α-аміно-β-оксипропіонова кислота) | 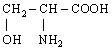
| Сер (Ser) | |||
| 11. L-Треонін (α-аміно-β-окси-масляна кислота) | 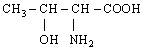
| Тре (Thr) | |||
| 12. L-Цистеїн (α-аміно-β-тіопропіонова кислота) | 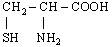
| Цис (Cys) | |||
| 13. Цистин | 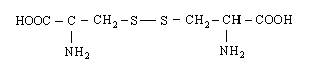
| Цит (Cyt) | |||
| 14. L-Тирозин (α-аміно-β-параоксифенілпропіонова кислота) | 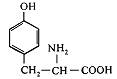
| Тир (Туr) | |||
| 15. L-Аспарагін (амід аспарагінової кислоти) | 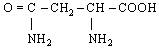
| Асн (Asn) | |||
| 16. L-Глутамин (амід глутамінової кислоти) | 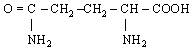
| Глн (Gln) | |||
| III. Негативно заряджені (кислі) амінокислоти | |||||
| 17. L-Аспарагінова кислота (α-амінобурштинова кислота) | 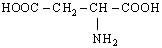
| Асп (Asp) | |||
| 18. L-Глутамінова кислота (α-аміноглутарова кислота) | 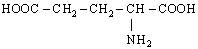
| Глу (Glu) | |||
| IV. Позитивно заряджені (основні) амінокислоти | |||||
| 19. L-Лізин (α, ε-диамінокапронова кислота) | 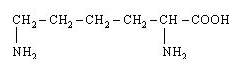
| Лиз (Lys) | |||
| 20. L-Аргінін (α-аміно-β-гуанідинвалеріанова кислота) | 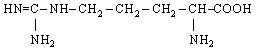
| Арг (Arg) | |||
| 21. L-Гістидин (α-аміно-β-імідазолілпропіонова кислота) | 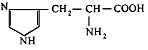
| Гис (His) | |||
Аміногрупи амінокислот (пептидів, білків) можуть вступати в реакцію з карбонільними групами альдегідів і цукрами, що відновлюються. Це реакції меланоїдиноутворення.
Одержувані з амінокислот альдегіди мають приємний запах. Сполучення запахів різних альдегідів визначає аромат багатьох харчових продуктів. Фурфурол (оксиметилфурфурол) легко вступає в подальші реакції, утворюючи меланоїдини. Поява останніх обумовлює потемніння ряду продуктів при їхньому виготовленні і збереженні. Особливо інтенсивно протікають реакції меланоїдиноутворення при підвищенні температури: під час сушіння овочів, плодів, випічці хліба, жаренні горіхів, кави, консервуванні молока, виготовленні кондитерських виробів, солоду, цукрових розчинів, при тепловій обробці вина і т.п.
Утворення пептидного зв'язку. Якщо карбоксильна група однієї АК ацилює аміногрупу іншої АК, то утворюється амідний зв'язок, який називають пептидним. Тому пептиди – це сполуки, які утворені з залишків a-АК, з'єднаних між собою пептидним зв'язком.
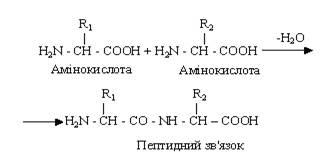
Даний зв'язок достатньо стабільний і розрив його відбувається лише за участю каталізаторів – специфічних ферментів. За допомогою такого зв'язку АК об'єднуються в достатньо довгі ланцюжки, які носять назву поліпептидних.
Початком поліпептидного ланцюга прийнято вважати амінокислоту з вільною a-аміногрупою (N – кінцева амінокислота), кінцем – амінокислоту з вільною карбоксильною групою (С – кінцева амінокислота). Найменування пептидів складається з назви першої амінокислоти з типовим для ацилів закінченням -іл, назва наступних амінокислот (також із закінченням -іл) і повної назви останньої амінокислоти (закінчення не змінюється). Наприклад, зображений нижче тетрапептид називається гліцил-аргініл-глутаміл-аланін, або скорочено Глі-Арг-Глн-Ала.
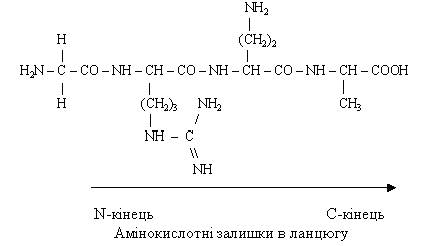
Поліпептиди, які здатні мимоволі формувати і утримувати певну просторову структуру, яка називається конформацією, відносять до білків. Стабілізація такої структури можлива лише при досягненні поліпептидами певної довжини. Тільки маючи певну просторову будову, білок може функціонувати.
біологічна роль окремих амінокислот. Гліцин або глікокол. Гліцин є попередником пуринового кільця гема гемоглобіна крові і утворює так звані парні сполуки з жовчними кислотами, наприклад, з холевою кислотою він утворює глікохолієву кислоту, з бензойною кислотою – гіпурову кислоту.
Глікохолієва кислота бере участь у процесах засвоєння ліпідів, а у формі гіпурової кислоти з організму виводиться токсична бензойна кислота.
Аланін як бічний ланцюжок входить до складу циклічних амінокислот (фенілаланін, тирозин, гістидин, триптофан). Біологічна роль визначається також наявністю його похідних: серин, цистеїн, цистін.
Цистеїн. У тканинах організму легко здійснюється ферментативна окиснювально-відновна реакція, обумовлена наявністю в цистеїні реакційно здатної SH-групи. При цьому утворюється цистін.
Властивість даної амінокислоти окиснюватися додає їй захисні і радіопротекторні властивості. У присутності цистеїну знижується інтенсивність окисних процесів у ліпідах і білках, підвищується стійкість організму до іонізуючого випромінювання і стабілізується якість прийнятих лікарських препаратів. При участі двох залишків цистеїну в поліпептидних ланцюгах утворюються дисульфідні зв'язки, що обумовлюють біологічну активність або функціональні властивості білків у складі їжі. Особливо важливу роль дисульфідні зв'язки грають у білках пшениці, тому що вони додають клейковині пружні властивості.
Три амінокислоти – аргінін, гліцин і метіонін – беруть участь у синтезі креатину – сполуки, за допомогою якої в м'язовій тканині відбувається безперервний ресинтез макроерга АТФ (аденозинтрифосфорної кислоти).
При участі креатину в організмі людини і тварин утворюється креатин- фосфат, що в міру необхідності віддає свою фосфатну групу молекулам АДФ, перетворюючись в креатинін:
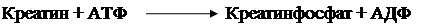 |
Креатин і циклічний креатинін входять до складу м'ясного екстракту, їхнє співвідношення залежить від рН середовища і температури. Так, при нагріванні м'яса в кислому середовищі в екстракті переважає креатинін.
Амінокислоти цитрулін і орнітин беруть участь разом з аргініном у циклі утворення сечовини у людини і тварин.
Фундаментальну роль в обміні речовин живих організмів грають глутамінова і аспарагінова кислоти. Вони беруть участь у процесах розщеплення, синтезу і переносу активних груп, часто у формі амідів.
Глутамін, наприклад, є основною формою переносу аміаку в крові людини і разом з аспарагіновою кислотою служить попередником пиримідинового кільця нуклеотидів.
Реакції декарбоксилювання глутамінової кислоти з утворенням g-аміномасляної кислоти, що відноситься до групи медіаторів центральної нервової системи, приділяється важлива роль в обміні речовин у мозку і нервовій тканині.
З обміном глутамінової кислоти тісно зв'язаний обмін проліну, що синтезується з неї в результаті відновлення проліндегідрогеназою. Пролін відіграє важливу роль у формуванні структури колагену і білків пшеничної клейковини, викликаючи вигини в поліпептидних ланцюгах.
У колагені, поряд із проліном, зустрічаються 4-оксипролін і 5-оксилізин, що утворюються за рахунок окиснювання відповідних амінокислот вже після включення в білок. Присутність оксипроліну в м'ясних і ковбасних виробах впливає на їхню якість і враховується при її оцінці.
Основна фізіологічна роль іншої сірковмісної амінокислоти – метіоніну зв'язана з наявністю лабільної метильної групи. Віддаючи групу -СН3, метіонін бере участь у синтезі гліцерофосфоліпідів. Фізіологічна роль амінокислоти серин полягає в тому, що вона у великій кількості входить до складу складних білків – фосфопротеїдів (казеїну молока і вітеліну яйця).
Незамінна амінокислота триптофан служить попередником нікотинової кислоти, серотоніну і індолілоцтової кислоти – гормону росту рослин. Серотонін володіє судинозвужувальною дією, синтезується в клітинах кишечнику і нервової тканини.
Тирозин є відповідальним за пігментацію волосся, шкіри, очей, за темний колір харчових продуктів (наприклад, житнього хліба), тому що з його участю синтезуються темнозабарвлені пігменти – меланіни. Механізм реакції до кінця не вивчений, але відомі перші етапи їхнього синтезу. Під дією мідьвмісного ферменту тирозин перетворюється в диоксифенілаланін (ДОФА), що далі окиснюється, циклізується, перетворюється в індолхінон. Полімеризація останнього приводить до синтезу меланинів.
Утворення меланинів підсилюється під впливом ультрафіолетових променів (при засмазі) і може бути причиною злоякісних новоутворень. При спадкоємному захворюванні – альбінізмі, що характеризується відсутністю ферменту тирозинази, навпаки, не спостерігається пігментація шкіри, волосся. Тирозин утворюється з фенілаланіну.
З тирозину і триптофану, що містяться в їжі, при участі мікробних ферментів у кишечнику утворюються отрутні продукти – крезол, фенол, скатол, індол, знешкодження яких відбувається в печінці шляхом зв'язування із сірчаною або глюкуроновою кислотами з утворенням нетоксичних (парних) кислот, наприклад, фенол-сірчаної кислоти.
У результаті декарбоксилювання амінокислот в організмі утворюються деякі важливі біогенні аміни. Декарбоксилювання аспарагінової кислоти забезпечує синтез аланіну, що є складовою частиною біологічно активних сполук, а декарбоксилювання лізину і орнітину під впливом ферментів кишкової мікрофлори призводить до утворення отрутних діамінів – кадаверину і путресцину. У здоровому організмі обидва аміни цілком знешкоджуються в слизовій оболонці кишечнику.
Частина амінокислот виконує роль медіаторів – речовин, що беруть участь у передачі нервових імпульсів від однієї нервової клітини до іншої. При роздратуванні нервових волокон медіатори реагують зі специфічним рецептором і забезпечують відповідну фізіологічну функцію: регуляцію сну, пильнування, серцево-судинну діяльність, терморегуляцію тіла. До медіаторів відносяться ацетилхолін, глютамінова і аспарагінова кислоти, гліцин, гістамін, серотонін, норадреналін та інші.
Таким чином, наведені відомості показують, яку велику роль грають амінокислоти в синтезі найважливіших фізіологічно активних сполук в організмі і забезпеченні деяких властивостей харчової сировини і продуктів.
Дата добавления: 2020-03-17; просмотров: 1172;











