Предмет і завдання біохімії. Хімічний склад організму
ВСТУП.Біологічна хімія – це наука, що вивчає хімічну природу речовин, з яких побудовано організм, закономірності їхніх перетворень, тобто усі хімічні процеси, що відбуваються в живому організмі від надходження до нього поживних речовин і до утворення та виведення кінцевих продуктів обміну речовин, а також роль хімічних речовин, що регулюють ці процеси. Саме тому, вивчення біологічної хімії є дуже важливим для спеціалістів, що працюють в харчових галузях виробництва, забезпечують виробництво, транспортування, зберігання, приготування та споживання продуктів харчування та страв. Опорний конспект розраховано на студентів технологічних та товарознавчих факультетів економічних вузів та вузів харчової промисловості, споживчої кооперації та економічних, які готують спеціалістів для галузі харчування, виробництва продуктів харчування, їх зберігання, переробки, контролю якості.
Опорний конспект складено у відповідності до програм курсу „Біологічна хімія”.
Біологічна хіміяє наука про речовини, з яких складаються живі організми і про хімічні процеси життєдіяльності. Структуру, класифікацію і властивості речовин вивчає статична біохімія, а процеси перетворення цих речовин в організмі – динамічна біохімія. Біохімічні процеси, що відбуваються в окремих органах і тканинах під час функції, вивчає функціональна біохімія.
Біохімічні процеси і методи використовуються в різних галузях сільськогосподарського виробництва, харчової промисловості: у переробці рослинної і тваринної сировини, забезпеченні її збереження, захисту від псування готової продукції, у боротьбі з наслідками несприятливого впливу людини на навколишнє середовище.
Всі живі об'єкти складаються з неживих молекул, які поза клітиною підкоряються всім фізичним і хімічним законам. Живі організми володіють низкою особливих властивостей, які відсутні в скупченнях неживої матерії. Серед цих властивостей можна виділити чотири основних:
Складність і високий рівень організації.Живі організми містять численні хімічні сполуки різноманітної будови і володіють ускладненою внутрішньою структурою. Навпаки, навколишнє середовище – грунт, вода і ін. – це неврегульовані суміші відносно простих хімічних сполук.
Кожна складова частина живого об'єкту має спеціальне призначення і виконує певну функцію.
Видобування з навколишнього середовища енергії для побудови і підтримки своєї складної структури. При цьому як сировина використовуються прості хімічні сполуки.
Здібність до точного самовідтворення – це основоположна властивість життя й найдивовижніша властивість живого.
Тому можна сказати, що життямає макромолекулярну систему, що здійснює регульований обмін речовин і енергії, а також процес самовідтворення.
Мінімальна структурна одиниця цієї системи – клітина (рис.1), в якій 6 обов'язкових надмолекулярних утворень або органел:
- Клітинна мембранавідмежовує вміст клітини від зовнішнього середовища і основна функція її є регуляція обміну речовин між клітиною та навколишнім середовищем.
- Мітохондрії– унікальні утворення, в яких відбувається запасання і вивільнення енергії хімічних зв'язків.
- Ядро– місце локалізації молекул-носіїв генетичної інформації (ДНК).
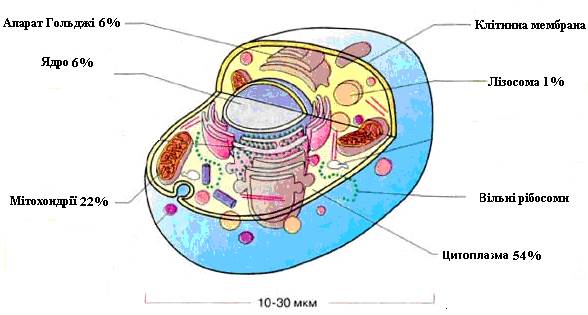
Рис. 1. Схема будови клітини
- Рибосоми – органела, на якій реалізується генетична інформація шляхом синтезу біомолекул по матриці з ядра.
- Лізосомимістять усередині речовини (ферменти), що розщеплюють складні сполуки на простіші.
- Апарат Гольджібере участь в утворенні лізосом і клітинних мембран.
Живі організми постійно взаємодіють із зовнішнім середовищем, одержуючи поживні речовини, що потім переробляються і виділяються з організму у вигляді продуктів обміну.
Усі процеси, що відбуваються в організмі, вимагають енерговитрат, які поповнюються за рахунок запасів поживних речовин у клітинах і їжі, що надходить в організм.
Харчування – постійно діючий фактор, що сприяє не тільки нормальному росту і розвитку організму, але й підвищує його захисні властивості. На сучасну людину впливають стреси, прискорений темп життя, гіподинамія, забруднення зовнішнього середовища і т.д., в цих умовах особливо велике значення має якісне харчування. Тим часом їжа сучасної людини, в основному, рафінована, із усякими добавками і консервантами. Значна частина населення світу недоїдає. Саме неправильне харчування «винне» у масовому поширенні так званих «хвороб цивілізації»: ожиріння, захворювань серцево-судинної системи, рака і ін.
В даний час відомо більш 60 харчових речовин, що повинні входити в раціон харчування як обов'язкові компоненти. Частина з них (білки, жири, вуглеводи, вітаміни) люди і тварини одержують у вигляді складних органічних сполук, що утворюються в рослинах з більш простих за рахунок сонячної енергії, що поглинається ними. Мінеральні речовини надходять, в основному, у вигляді простих сполук. Незамінною харчовою речовиною є вода.
У природі немає таких продуктів, що містили б усі харчові речовини в кількісних співвідношеннях, необхідних для нормального обміну речовин в організмі людини. Тільки шляхом сполучення різноманітних продуктів можна забезпечити організм усіма харчовими речовинами, яких він потребує.
До основних харчових речовин (нутрієнтів) відносяться білки, жири, вуглеводи, вітаміни, мінеральні речовини, вода.
Білки. Це незамінні харчові речовини, які повинні надходити з їжею при кожному основному її прийомі. Вся життєдіяльність організму пов’язана з різними білками, що входять до складу клітин, де ці речовини виконують різноманітні функції.
Для визначення норм білків в раціоні велике значення має той факт, що вони в запас не відкладаються. При білковій недостатності в першу чергу знижується стійкість організму до шкідливих впливів, порушується ряд основних процесів обміну, що призводить до захворювань, нерідко із летальним ісходом. В той же час великий вміст білку в раціоні впливає подразливо на нервову систему, призводить до перевантаження органів, безпосередньо пов’язаних з видаленням продуктів розпаду білкових речовин. Надлишок білку підвищує активність системи згортання крові, а також чутливість до алергенів, тобто підсилює реактивність організму по відношенню до різних речовин, в тому числі і до тих, що містяться в деяких харчових продуктах.
Не всі харчові білки рівноцінні. Частина з них (головним чином рослинного походження) не може забезпечити нормальне функціонування організму, особливо, того, що зростає, так як вони не мають всього набору незамінних амінокислот.
Біологічно цінні білки містяться в м’ясі і субпродуктах, рибі і морепродуктах, сирі, яйцях, сої, молоці та молочних продуктах.
Вуглеводи – це харчові речовини, джерелами яких є рослини, що містять крохмаль, цукор (буряковий і молочний), глюкозу, фруктозу.
В організмі людини енергія з вуглеводів легко вивільняється не тільки в умовах достатнього постачання тканин Оксигеном, але і при його нестачі. Так, наприклад, під час виконання інтенсивної фізичної роботи кров не встигає повністю забезпечити м’язи Оксигеном, і додаткова енергія виділяється за рахунок анаеробного окиснення вуглеводів.
Деякі вуглеводи входять до складу мозку, сполучної тканини, слизів. Велике їх значення в захисних реакціях організму.
Ліпіди. Це складна група харчових речовин, які беруть участь в побудові структур клітинних оболонок (мембран), в утворенні гормонів (кори наднирок, статевих залоз, простагландинів) та інших процесах. Частина ліпідів в організмі не утворюється, тому вони повинні обов’язково надходити з їжею. До таких речовин відносяться деякі ненасичені жирні кислоти, зокрема незамінна для організму лінолева кислота, яка міститься в рослинних оліях (соняшниковій, кукурудзяній, соєвій, конопляній та ін.).
В тканинах жири окиснюються важче, ніж вуглеводи, тому слід дотримуватися певного співвідношення даних харчових речовин: в раціоні на 1 г жирів повинно надходити не менше 4 г вуглеводів.
Значно важливим з точки зору раціонального харчування є властивості жирів (особливо які містять насичені жирні кислоти) в тканинах. Жири «захоплюють» все нові ділянки, відкладаються в органах (наприклад, серці) і заважають їх нормальній діяльності. Заповнюючи клітину, жири відтісняють цитоплазму і ядро до периферії і знижують в них інтенсивність обміну речовин.
Вітаміни – низькомолекулярні органічні речовини, необхідні для життєдіяльності організму. Вони беруть участь в процесах обміну речовин, розмноження і т.д. Добова потреба людини у вітамінах виражається в мінімальних дозах (мг, мкг). В зв’язку з тим, що в організмі вони не синтезуються або утворюються в недостатній кількості, їх відносять до незамінних факторів харчування. Основними джерелами вітамінів для людини служать продукти харчування рослинного і тваринного походження.
Класифікація вітамінів ґрунтується на їх здатності розчинятися у воді або жирах, в зв’язку з чим виділяють водо- і жиророзчинні вітаміни. В групу водорозчинних входять вітаміни В1, В2, В6, В12, С, РР, фолієва кислота та ін. До жиророзчинних відносяться вітаміни групи А, Д, Е, К, F. Найбільш дефіцитними вітамінами є А, В1, В2, С. Це зумовлено в основному тим, що вони легко руйнуються при зберіганні і технологічній обробці продуктів. Так, дефіцит вітамінів групи В пов’язаний з видаленням периферичної частини зерна (де вони містяться) в процесі виготовлення білого борошна, манної крупи, очищеного рису і інших продуктів.
Порушення в забезпеченні організму вітамінами можуть проявитися у вигляді авітамінозу (внаслідок відсутності вітамінів), гіповітамінозу (недоліку вітамінів) і гіпервітамінозу (надлишкового накопичення якого-небудь вітаміну), кожен з яких має специфічні симптоми.
Мінеральні речовини – незамінні фактори харчування, оскільки вони не синтезуються в організмі. Ці речовини необхідні для діяльності любої клітини, вони входять до складу ферментів, гормонів, беруть участь в побудові органоїдів клітини, в м’язовому скороченні, проводимісті нервових імпульсів, підтримуванні осмотичного тиску і постійності рН внутрішнього середовища і т.д.
Харчові продукти містять різні мінеральні речовини: Натрій, Калій, Кальцій, Магній, Ферум, Купрум, Цинк, Манган, Хром, Хлор, Сульфур, Йод, Флуор та ін. Вони входять до складу мінеральних солей і складних органічних сполук. Звичайно в харчовому раціоні недостає Кальцію і Ферума на відміну від Натрію і Фосфору, яких часто буває в надлишку. Джерело засвоюваного Кальцію – молоко, молочні продукти; Ферума – жовток яйця, печінка та інші продукти тваринного походження.
Мінеральні речовини, що входять до складу живих організмів, умовно поділяють на три групи: макро-, мікро- і ультрамікроелементи. До макроелементів відносять ті хімічні елементи, вміст яких перевищує 0,001 % (О, C, Н, Са, K, N, P, S, Mg, Na, Cl, Fe і ін.). Якщо вміст хімічного елемента в організмі складає від 0,001 до 0,000001 %, то його зараховують до мікроелементів (Сu, Мn, Co і ін.). Речовини, що знаходяться в ще менших кількостях, називають ультрамікроелементами (Pb, V, Au, Hg і ін.).
Характеристика окремих елементів.
Натрій – основний катіон позаклітинного відділу. Він складає 0,08 % від маси тіла. Грає головну роль в підтримці осмотичного тиску. За відсутності або обмеженні в надходженні Натрію в організм його виділення з сечею майже повністю припиняється. Всмоктується він у верхньому відділі тонкого кишечнику за участю білків-переносників і вимагає затрати АТФ. Добова потреба варіює залежно від водно-сольового забезпечення організму. Депонується в шкірі і м'язах. Кишкова втрата Натрію відбувається при діареях.
Натрій бере участь у виникненні і підтримці електрохімічного потенціалу на плазматичних мембранах кліток, регулює стан водно-сольового обміну, бере участь в регуляції роботи ферментів. Він є компонентом K+ – Na+ насоса.
Хлор – найважливіший аніон позаклітинного простору. Складає 0,06 % від маси тіла. Велика частина його міститься в шлунковому соку. Бере участь в підтримці осмотичної рівноваги. Активує амілазу і пептидазу. Всмоктується у верхніх відділах кишечнику, виділяється в основному з сечею. Концентрація Хлору і Натрію звичайно змінюються паралельно.
Калій– складає 0,25 % від маси тіла. Міститься у клітинах, де пов'язаний з вуглеводними сполуками і тільки 2 %, від загальної кількості, у позаклітинному просторі. Всмоктується впродовж всього шлунково-кишкового тракту. Частина Калію відкладається в печінці і шкірі, а інша надходить в загальний кровотік. Обмін дуже швидко протікає в м'язах, кишечнику, нирках і печінці. У еритроцитах і нервових клітинах обмін Калію повільніший.
Калійграє провідну роль у виникненні і проведенні нервових імпульсів. Він необхідний для синтезу білків (на 1 г білка – 20 міліграм іонів Калія), АТФ, глікогену, бере участь у формуванні в клітинах потенціалу спокою.
Кальцій– позаклітинний катіон. Складає 1,9 % від маси тіла. Вміст підвищується в період росту або вагітності. Функціонує як складова частина опорних тканин або мембран, бере участь в проведенні нервового імпульсу і ініціації м'язового скорочення, є одним з факторів гемокоагуляції. Забезпечує цілісність мембран (впливає на проникність), оскільки сприяє щільній упаковці мембранних білків. Кальцій обмежено бере участь в підтримці осмотичної рівноваги. Разом з інсуліном активує проникнення глюкози в клітини. Всмоктується у верхньому відділі кишечнику. Ступінь його засвоєння залежить від рН середовища (солі кальцію в кислому середовищі нерозчинні). Жири і фосфати перешкоджають всмоктуванню Кальцію. Для повного засвоєння з кишечнику необхідна наявність активної форми вітаміну Д3.
Велика частина Кальцію міститься в кістковій тканині (99%) у складі мікрокристалів карбонатапатита [3Са2(РО4)2 × СаСО3] і гидроксилапатита [3Са2(РО4)2 × СаОН]. Загальний Кальцій крові включає три фракції: білково-звязаний, іонізований і неіонізований (який знаходиться у складі цитрату, фосфату і сульфату).
Магній– складає 0,05% від маси тіла. У клітинах його міститься в 10 разів більше, ніж в позаклітинній рідині. Багато Магнію в м'язовій і кістковій тканині, також в нервовій і печінковій. Утворює комплекси з АТФ, цитратом та деякими білками.
Магнійвходить до складу майже 300 ферментів. Комплекси Магнію з фосфоліпідами знижують текучість клітинних мембран. Він бере участь в підтримці нормальної температури тіла, в роботі нервово-м'язового апарату.
Неорганічний Фосфор– міститься переважно в кістковій тканині. Складає 1 % від маси тіла. У плазмі крові при фізіологічних рН Фосфор на 80 % представлений двовалентним і на 20 % одновалентним аніоном фосфорної кислоти. Фосфор входить до складу коферментів, нуклеїнових кислот, фосфопротеїдів, фосфоліпідів. Разом з Кальцієм Фосфор утворює апатити – основу кісткової тканини.
Купрум входить до складу багатьох ферментів і біологічно активних металопротеїдів. Бере участь в синтезі колагену і еластину. Є компонентом цитохрому оксидази транспортного ланцюга біологічного окиснення.
Сульфур– складає 0,08 % від маси тіла. Надходить до організму в зв'язаному вигляді у складі АК і іонів сульфату. Входить до складу жовчних кислот і гормонів. У складі глутатіону бере участь в біотрансформації отрут.
Ферум входить до складу залізовмісних білків і гема гемоглобіну, цитохромів та пероксидаз.
Цинк – являється кофактором ряду ферментів.
Кобальт –входить до складу вітаміну В12.
Вода – важливий компонент харчового раціону. Зневоднення призводить до небезпечних наслідків самоотруєння організму внаслідок затримки видалення продуктів розпаду – при накопиченні в крові і тканинах вони стають токсичними.
Надлишок води веде до перевантаження серцево-судинної системи і системи виділення.
Смакові речовини. Своєрідний аромат і смак мають продукти, в яких містяться складні органічні сполуки (ефірні олії). Вони збуджують апетит і посилюють виділення травних соків.
Деякі з цих сполук проявляють фітонцидні властивості: затримують або припиняють життєдіяльність мікроорганізмів. Фітонциди є в гірчиці, хроні, цибулі, часнику, петрушці, моркві та деяких інших рослинах. Більшість фітонцидів нестійкі і руйнуються при тепловій обробці, подрібненні або зберіганні продуктів.
Завдяки наявності речовин, що надають продуктам своєрідного смаку та запаху, такі продукти, як лавровий лист, кардамон, гвоздика, кориця, ванілін, тмин, каперси, укріп, м’ята, селера збуджують апетит.
На смакові якості їжі впливає наявність органічних кислот, що входять до складу ряду продуктів. Одні кислоти легко окиснюються в організмі, отже, вони є харчовими речовинами, інші – не засвоюються. До харчових кислот відносяться молочна, лимонна, винна, яблучна, оцтова. Вони стимулюють виділення травних соків.
Нехарчові речовини. Поряд з розглянутими групами речовин до складу продуктів рослинного і тваринного походження входить ряд хімічних сполук, які не є джерелами енергії, пластичного матеріалу тощо. Їх називають нехарчовими. До таких речовин відносяться харчові волокна (клітковина, пектин), біологічно активні речовини, а також хімічні забруднювачі, зокрема, нітрати, пестициді, гербіциди, що потрапляють в їжу із оточуючого середовища.
Білки, амінокислоти: будова, властивості, біологічна роль. Класифікація.
Всі прояви життєдіяльності – подразнення, травлення, рух, розмноження та інші – пов'язані з білками, вони є незамінними структурними компонентами організму людини, тварин, рослин, мікроорганізмів.
Білки, які поступають з їжею до організму людини, перетравлюються в шлунково-кишковому тракті, перетворюючись на амінокислоти, з яких у тканинах утворюються власні білки з різними функціями: каталітичною (ферменти), захисною (імунні сполуки, антитіла та ін.), інформаційною, регуляторною (ряд гормонів), репродуктивною (разом з нуклеїновими кислотами), транспортною. Вони також беруть участь у багатьох інших життєво важливих процесах.
Функції білків:
–Структурна (пластична) – білками утворені багато клітинних компонентів, а в комплексі з ліпідами вони входять до складу клітинних мембран.
- Каталітична – всі біологічні каталізатори – ферменти, по своїй хімічній природі є білками.
- Транспортна – білок гемоглобін транспортує Оксиген, низка інших білків, утворюючи комплекс з ліпідами, транспортують їх по крові і лімфі (наприклад: міоглобін, сироватковий альбумін).
- Механічна – м'язова робота і інші форми руху в організмі здійснюються при безпосередній участі скорочувальних білків з використанням енергії макроергічних зв'язків (наприклад актин, міозин).
- Регуляторна – низка гормонів і інших біологічно активних речовин мають білкову природу (наприклад інсулін).
- Захисна – антитіла (імуноглобуліни) є білки, крім того основу шкіри складає білок колаген, а волосся – кератин. Шкіра і волосся захищають внутрішнє середовище організму від зовнішніх впливів. До складу слизу і синовіальної рідини входять мукопротеїди.
- Опорна – сухожилля, поверхні суглобів утворені в значній мірі білковими речовинами (наприклад колаген, еластин).
- Енергетична – амінокислоти білків можуть надходити до гліколізу, який забезпечує клітини енергією.
- Гомеостатична – білки входять до складу буферної системи крові.
- Репродуктивна – білки приймають участь у процесах росту та размноження.
- Рецепторна – багато білків беруть участь в процесах виборчого впізнавання (рецептори) гормонів.
РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ у сучасній літературі прийнято розглядати 4 рівні організації структури молекули білка.
Первинним рівнем (або структурою) – організації білкової молекули називають послідовність амінокислотних залишків, з'єднаних між собою пептидним зв'язком.
Вторинною структурою – називають просторове розташування атомів головного ланцюга молекули білка. Утворюється і утримується в просторі за рахунок утворення водневих зв'язків між боковими угрупуваннями АК основного ланцюга.
Третинна структура – це властивий даному білку спосіб укладання поліпептидного ланцюга у просторі. Це основа функціональності білка. Вона забезпечує стабільність обширних ділянок білків, що складаються з безлічі амінокислотних залишків та бокових груп. Такі впорядковані в просторі ділянки білка формують активні центри ферментів або зони зв'язування. Пошкодження третинної структури приводить до втрати функціональної активності білка.
Стабільність третинної структури залежить в основному від нековален-тних взаємодій всередині білкової глобули, а переважно водневих зв'язків і ван-дер-ваальсових сил. Але деякі білки додатково стабілізуються за рахунок таких ковалентних взаємодій як дисульфідні містки між залишками цистеїну.
Більшість білкових молекул мають ділянки як α-спіралі так і β-складчастості. Але частіше за формою третинної структури білки розділяють на глобулярні – які побудовані на основі α -спіралі і мають форму кулі або еліпса (більшість ферментів). І фібрилярні – що складаються на основі β-складчастості і які мають сплюснуту або ниткоподібну форми (пепсин, білки сполучної тканини і хряща).
Четвертинною структурою – називається розміщення в просторі взаємодіючих між собою субодиниць, утворених окремими поліпептидними ланцюгами. Тобто у формуванні четвертинної структури беруть участь не пептидні ланцюги, а глобули, які утворені з кожного з цих ланцюгів окремо. Четвертинна структура – це вищий рівень організації білкової молекули і він властивий далеко не всім білкам. Зв'язки, що формують цю структуру не ковалентні: водневі, електростатичної взаємодії.
Фізико-хімічні властивості білків. Розчини білка відносять до розчинів високомолекулярних систем які володіють низкою властивостей гідрофільних колоїдів: повільною дифузією – не здатні проникати через напівпроникні мембрани, високою в'язкістю – утворення драглів, опаслеценцією – розсіюють світло, дають конус Тіндаля.
1.Амфотерністьпов'язана з наявністю в молекулі білка катіонообра-зуючих груп – аміногруп і аніонообразуючих – карбоксильних груп. Знак заряду молекули залежить від кількості вільних груп. Якщо мають перевагу карбоксильні групи то заряд молекули негативний (виявляються властивості слабої кислоти), якщо аміногрупи – то позитивний (основні властивості).
Заряд білка також залежить від рН середовища. У кислому середовищі молекула набуває позитивного заряду, в лужній – негативного.
Значення рН, при якому число різнойменних зарядів в білковій молекулі однаково, тобто сумарний заряд рівний нулю, називається ізоелектричною точкоюданогобілка. Стійкість білкової молекули до дії фізичних і хімічних факторів в ізоелектричній точці найменша.
Більшість природних білків містять значну кількість дикарбонових амінокислот і тому відносяться до кислих білків. Їх ізоелектрична точка лежить в слабокислому середовищі.
2. Розчини білків володіють буферними властивостямиза рахунок їх амфотерності.
3. Розчинність. Оскільки молекула білка містить полярні аміно- і карбоксильні групи, то в розчині поверхневі залишки АК гідратуються – відбувається утворення коацервата.
4.Коацервація– злиття водних оболонок декількох часток, без об'єднання самих часток.
5.Коагуляція– склеювання білкових часток і випадіння їх в осад. Це відбувається при видаленні їх гідратної оболонки. Для цього досить змінити структуру частинки білка так, щоб її гідрофільні групи, які зв'язують воду розчинника, опинилися всередині частинки. Реакції осадження білка в розчині діляться на дві групи: зворотні (висолювання) і незворотні (денатурація).
6. Висолюванням називається
6.Денатурацієюназивається суттєва зміна вторинної і третинної структури білка, тобто порушення системи нековалентних взаємодій, що не зачіпає його ковалентної (первинної) структури. Денатурація буває незворотною й зворотною. Денатурований білок позбавлений всякої біологічної активності в клітині і в, основному, використовується як джерело амінокислот. Денатуруючими агентами можуть бути хімічні фактори: кислоти, луги, що легко гідратують, солі, органічні розчинники, різні окиснювачі. До фізичних факторів можуть бути віднесені: дія високого тиску, багатократне заморожування і відтаювання, ультразвукові хвилі, УФ-промені, іонізуюча радіація. Та найбільш поширеним фізичним фактором денатурації білка є підвищення температури. Така денатурація називається незворотною.
Денатурація білка, яка відбувається при розтиранні сухих препаратів, енергійному струшуванні розчинів, збиванні, ліофілізації білків (висушування у вакуумі шляхом сублімації вологи з замороженого стану) – називається зворотною.
Класифікація білків:
За розчинністю: водорозчинні, сольоворозчинні, спирторозчинні, нерозчинні і ін.
По конформаційній структурі: фібрілярні, глобулярні.
По хімічній будові: прості білки – протеїни – складаються тільки з амінокислот, складні білки – протеїди – крім АК мають в складі небілкову частину (вуглеводи, ліпіди, метали, нуклеїнові кислоти)
До протеїнів відносять:
1. Альбуміни – розчинні у воді, не розчинні у концентрованих. сольових розчинах рН = 4,6…4,7. Існують альбуміни молока, яєць, сироватки крові.
2. Глобуліни – не розчинні у воді, розчинні у сольових розчинах. Імуноглобуліни відносять до цієї групи.
3. Гістони – розчинні у воді, у слабоконцентрованих кислотах. Володіють вираженими основними властивостями. Це ядерні білки, вони пов'язані з ДНК і РНК.
4. Склеропротєїни – білки опорних тканин (хрящів, кісток), шерсті, волосся. Не розчинні у воді, слабких кислотах і лугах.
а) колагени – фібрілярні білки сполучної тканини. При тривалому кип’ячені вони розчиняються у воді і при застиганні утворюється желатин.
б) еластини – білки зв'язок і сухожиль. По властивостях схожі на колаген, але піддаються гідролізу під дією ферментів травного соку;
в) кератин – входить до складу волосся, пір'я, копит;
г) фиброін – білок шовку, в своєму складі містить багато серину;
д) проламіни і глютеніни – білки рослинного походження.
Протеїди
Ці білки залежно від її хімічної природи простетичної групи класифікуються на:
1. Нуклеопротєїди – простетична група – нуклеїнові кислоти. Серед численних класів нуклепротеідів найбільш вивченими є рибосоми, що складаються з декількох молекул РНК і рибосомних білків, і хроматин, який складається з ДНК і структурообразуючих білків – гістонів (містяться в клітинному ядрі і мітохондріях).
2.– Гемопротєїди – небілковий компонент цих протеїдів – гем, побудований з чотирьох пирольних кілець. З ними пов'язаний іон двовалентного заліза (через атом азоту). До таких білків відносяться: гемоглобін, міоглобін, цитохроми. Цей клас білків ще називають хромопротеїди, оскільки гем є забарвленим з'єднанням. Гемоглобін здійснює важливу функцію – транспортує кисень. Міоглобін забезпечує запасання кисню в м'язах. Цитохроми (ферменти) здійснюють каталіз окиснювально-відновлювальних реакцій і електронний транспорт у дихальному ланцюзі.
3.– Металопротєїди – до складу простетичної групи входять метали. Хлорофіл містить гем, але в ньому замість заліза знаходиться магній. Цитохроми містять мідь.
4.–Ліпопротєїди – крім білка містять ліпіди. Вони входять до складу клітинних мембран.
5.– Фосфопротєїди – крім білка містять залишок фосфорної кислоти.
6.– Глюкопротєїди – крім білка містять вуглеводи.
Біологічна цінність білків.
Білки – найважливіші компоненти харчування. Здатність білка виконувати функцію харчування характеризує його біологічну цінність. Ефективність споживання білкових речовин людиною визначається двома основними факторами: збалансованістю вмісту незамінних амінокислот у білку і його засвоюваністю. Якщо не задовольняється потреба в одній з незамінних амінокислот, то обмежується використання інших, і, отже, знижується цінність білка в цілому. Незамінна амінокислота, що знаходиться в білку в мінімальній кількості, називається лімітуючою амінокислотою, тому що вона найбільшою мірою зменшує біологічну цінність даного білка.
Збагачення харчових білкових продуктів відсутніми амінокислотами застосовується в харчуванні людини у виняткових випадках. Однак додавання синтетичних амінокислот до кормів тварин є звичайною справою. Подібним чином в усім світі готують кормові суміші для домашніх птахів, свиней, корів, що дозволяє більш ощадливо витрачати корми. Відомо, що добавки цих амінокислот поліпшують утилізацію білка тваринами приблизно на 20 %.
Біологічна цінність білка виражається у відносних величинах. Вона являє собою відношення досліджуваного параметра даного білка до подібного ж параметра «ідеального» білка. У якості останнього використовують казеїн молока, білок яєць, суміш м'язових білків, що легко переварюються і містять незамінні амінокислоти в співвідношеннях, близьких до еталонних. Біологічна цінність даного білка в порівнянні з еталонними показує, наскільки він здатний задовольняти потреби організму в амінокислотах. Для оцінки якого-небудь білка або харчового продукту необхідні дані про вміст у ньому окремих амінокислот, тобто його амінокислотний склад.
Частина рослинних білків (бобові) за своїм амінокислотним складом і біологічною цінністю близька до тваринних. Однак білки насіння більшості сортів зернових (рис, овес) дефіцитні за двома, а частіше (пшениця, кукурудза й ін.) за трьома і чотирма незамінними амінокислотами. Основною лімітуючою амінокислотою білків зернових культур є лізин. Лімітуючі амінокислоти білків зернових різні в насінні різних культур: у пшениці, рисі і житі – треонін, у кукурудзі – триптофан і т.д. Білки бобових культур відрізняються кращою збалансованістю незамінних амінокислот, що містяться в них, у порівнянні з білками злакових.
У тваринних білків дефіцит незамінних амінокислот виражений слабко. Деяким з них (білки молока, м'яса, субпродуктів) властивий недолік сірковміс-них амінокислот. У цілому для тваринних білків більш характерний надлиш-ковий в порівнянні з потребами організму вміст ряду незамінних амінокислот.
У харчуванні більшої частини населення земної кулі наявний дефіцит трьох незамінних амінокислот: лізину, триптофану і метіоніну. Різний амінокислотний склад рослинних і тваринних білків дозволяє підвищити їхню біологічну цінність при споживанні необхідної кількості різноманітної білкової їжі. Тільки таке харчування можна назвати повноцінним.
Амінокислоти, номенклатура та будова. Білки – полімери, що не розгалужуються, мінімальна структурна одиниця яких – амінокислота (АК). Амінокислоти з'єднані між собою пептидним зв'язком. У природі зустрічається близько 300 амінокислот, їх можна умовно розділити на дві групи:
1) вільні амінокислоти (непротеїногенні), що не беруть участь в утворенні білків. Так, безліч «небілкових» АК міститься в пептидних антибіотиках або є проміжними продуктами обміну білків.
2) протеїногенні, які ковалентно зв'язані одна з одною у складі пептидів і білків.
Непротеїногенні амінокислоти більш різноманітні в порівнянні з протеїногенними.
До складу білків входить 20 АК у α-формі, розташованих в різній, але строго визначеній для кожного білка послідовності. Загальна структурна формула a-амінокислот може бути представлена в наступному виді:
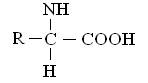
a- амінокислоти відрізняються одна від однієї структурою і складом групи R (бічний ланцюг).
Амінокислоти класифікуються відповідно:
за хімічною будовою
- Аліфатичні – гліцин (Глі), аланин (Ала), валін (Вал), лейцин (Лей), ізолейцин (Іле);
- Оксикислоти – серін (Сер), треонін (Тре);
- Дикарбонові – аспарагінова кислота (Асп), глутамінова кислота (Глу);
- Двоосновні – лізин (Ліз), гістидин (Гіс), аргінін (Арг);
- Ароматичні – феніналанін (Фен), тирозин (Тир), триптофан (Три);
- Сіркоутримуючі – цистеін (Цис), цистин (Цит), метіонін (Мет).
За біохімічним призначенням:
- Глюкогенні – через ряд хімічних перетворень надходять на шлях глі-колізу (окиснення глюкози) – Глі, Ала, Тре, Вал, Асп, Глу, Арг, Гіс, Мет.
- Кетогенні – беруть участь в утворенні проміжних продуктів ліпідного обміну кетонових тіл – Лей, Іле, Тир, Фен.
За харчовою цінністю:
- Незамінні – не синтезуються в організмі – Гис, Іле, Лей, Ліз, Мет, Фен, Тре, Три, Вал, а у дітей – Арг, Гис.
- Замінні – інші.
За рахунок наявності в молекулі АК одночасно амінної і карбоксильної груп цим сполукам властиві кислотно-основні властивості. У нейтральному середовищі АК існують у вигляді біполярних іонів.
Фізико-хімічні властивості амінокислот. За хімічними властивостями амінокислоти, що мають у своєму складі амінні і карбоксильні групи, є амфотерними електролітами.
Сучасна класифікація амінокислот основана на полярності радикалів.
Крім a-аміно- і a-карбоксильної груп, у загальному заряді молекули в складі кислих і основних амінокислот є ще і третя – іоногенна група в бічному ланцюзі. Такі амінокислоти несуть додатковий негативний або позитивний заряд.
Біполярність молекул амінокислот обумовлює такі їхні властивості, як гарна розчинність у воді, високі значення діелектричних постійних і температури плавлення.
Функціональні групи амінокислот різноманітні, що дозволяє виявляти більшість їх за допомогою кольорових реакцій. Багатьох з них, дуже чуттєвих і специфічних, виявляють навіть в малих кількостях у складі складних сумішей, біологічній сировині рослинного і тваринного походження, білках. Реакція з нінгідрином лежить в основі кількісного визначення амінокислот і білків.
При взаємодії нінгідрину з a-аміногрупою утворюється продукт синьо-фіолетового кольору з максимумом поглинання при 580 нм; інтенсивність фарбування при цьому пропорційна кількості амінокислоти. Амінокислота пролін дає з нінгідрином жовте фарбування (максимум поглинання при 440 нм). Цю реакцію використовують у різних видах хроматографії для ідентифікації і кількісного визначення амінокислот.
Таблиця 1
Дата добавления: 2020-03-17; просмотров: 879;











