Параметри стану. Рівняння стану
Фізичні величини, що визначають стан речовини або системи, називаються параметрами стану. Параметри, які залежать від маси, називаються екстенсивними, які не залежні від маси – інтенсивними. З іншого боку, параметри підрозділяються на термічні і калоричні:
| Термічні | Калоричні |
1. Абсолютний тиск – відношення сили до одиниці площі.
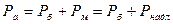
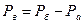 Ра – абсолютний тиск;
Рб – барометричний (атмосферний) тиск;
Рнадл=Рм – надлишковий або манометричний тиск;
Рв – вакуум (розрядження).
Ра – абсолютний тиск;
Рб – барометричний (атмосферний) тиск;
Рнадл=Рм – надлишковий або манометричний тиск;
Рв – вакуум (розрядження).
| 1.Внутрішня енергія – U, кДж, Дж,…
Питома внутрішня енергія 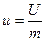 , Дж/кг.
Для ідеального газу u=f(t), а для реальних
u=f(Р,V,t). , Дж/кг.
Для ідеального газу u=f(t), а для реальних
u=f(Р,V,t).
|
| 2. Абсолютна температура – міра інтенсивності теплового руху молекул. Т(К)=t0C +273,15 | 2. Ентальпія I=U+PV, Дж, кДж,… Питома ентальпія, і=u+pv=І/т, Дж/кг. Для ідеального газу i=f(t), а для реальних i=f(Р,V,t). |
3. Об'єм – V,м3. Питомий об'єм 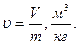
| 3. Ентропія – параметр стану, для якого 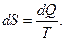 Позначення: S,
Позначення: S, 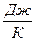 ;
Питома ентропія ;
Питома ентропія 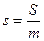 , , 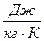 Ентропія – функція параметрів стану s=f(Р,V,t).
Ентропія – функція параметрів стану s=f(Р,V,t).
|
4. Густина 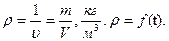
|
Якщо параметри стану системи постійні в часі й однакові в усіх точках, то такий стан системи називається рівноважним
Найпростішим рівнянням стану ідеального газу є рівняння Менделєєва – Клапейрона:
1. Для газу масою m: PV=mRT.
2. Для 1 кг газу PV=RT, де 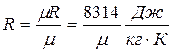 - газова стала, m - молярна маса газу.
- газова стала, m - молярна маса газу.
3. Для одного кіломолю PVμ=μRT, Vμ - об'єм кіломолю речовини, 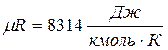 .
.
Нормальні фізичні умови:
| Р=760 мм.рт.ст.=101325 Па, | Т=273 К, | t=00C |
Нормальні технічні умови
| Р=735,6 мм.рт.ст.=98000 Па, | Т=288 К, | t=150C |
Дата добавления: 2020-02-05; просмотров: 1030;











